今回は天然物としてストリキニーネの全合成について片っ端から解説していこうと思います。ストリキニーネと言えば「毒コレクション」シリーズでも登場したマチンから抽出される猛毒アルカロイドで中枢神経興奮作用があります。

ストリキニーネの全合成に貢献したロバート・ロビンソンは「この分子量としては知られている中で最も複雑な化合物」とコメントを残したほどです。最初に全合成を達成したのが20世紀最大の有機化学者と呼ばれるロバート・バーンズ・ウッドワードです。今回ご紹介するのは日本人化学者によって達成された合成スキームで福山透先生のスキームをご紹介いたします。それでは始めましょう。
●ストリキニーネの全合成
まず最初の出発原料はなんと意外にも単純明快な安息香酸から。安息香酸はベンゼンにカルボキシ基という電子求引基が結合しているのでアルカリ金属(リチウムやナトリウム)と液体アンモニアでBirch還元すると以下のような化合物が得られます。
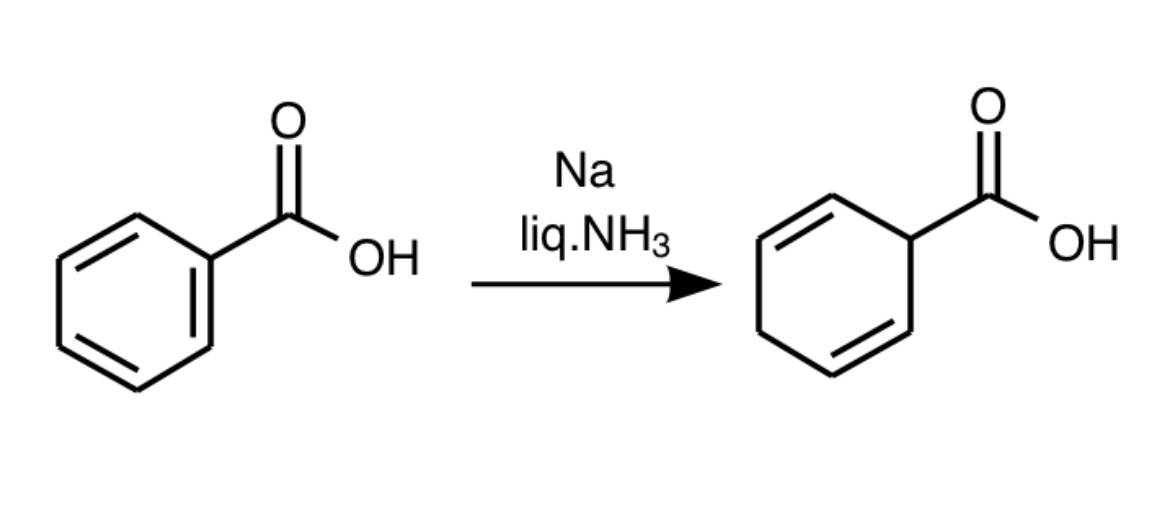
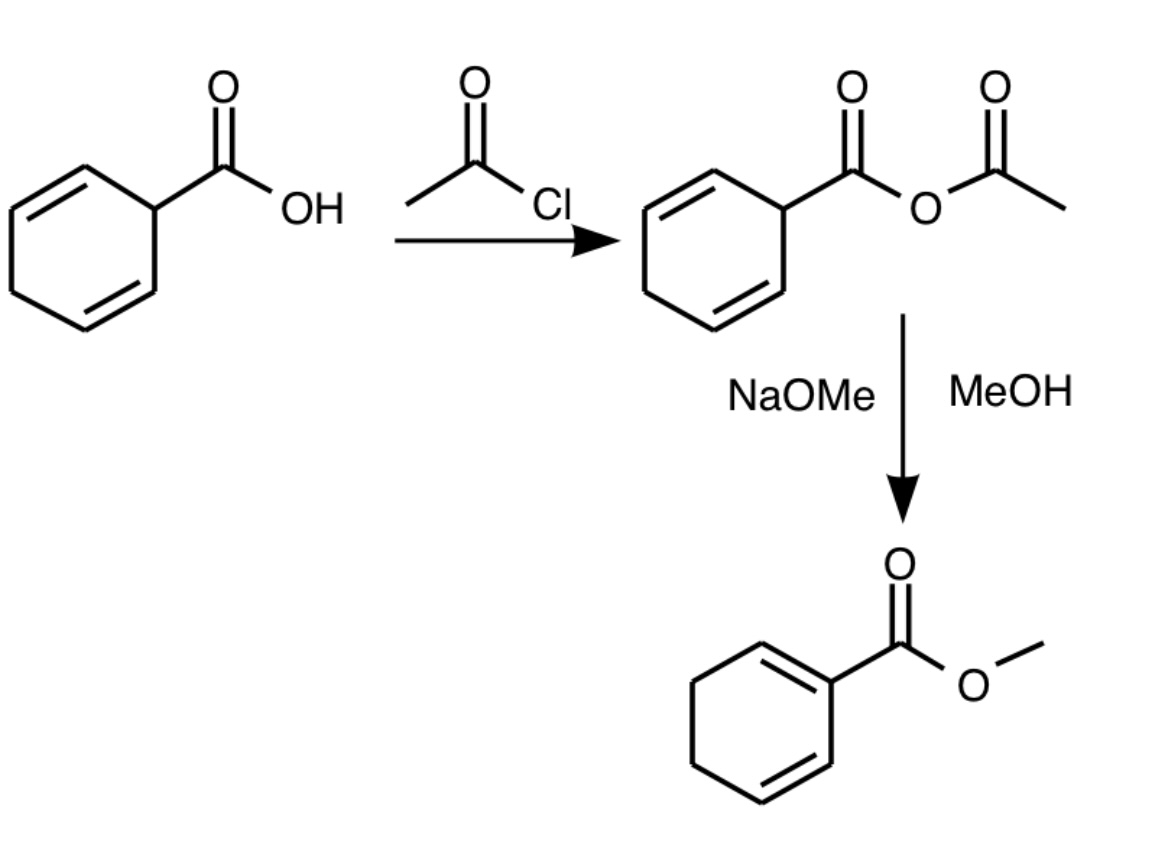
目的は共役ジエン化合物を得ることなのでカルボキシ基をアセチルクロリドでアセチル化したのちメタノールでメチルエステル化します。そのときπ電子の移動が起こり共役ジエンが得られます。ちなみにこの共役ジエンは電子求引基のカルボニルを持つためDiels-Alder反応では合成できません。
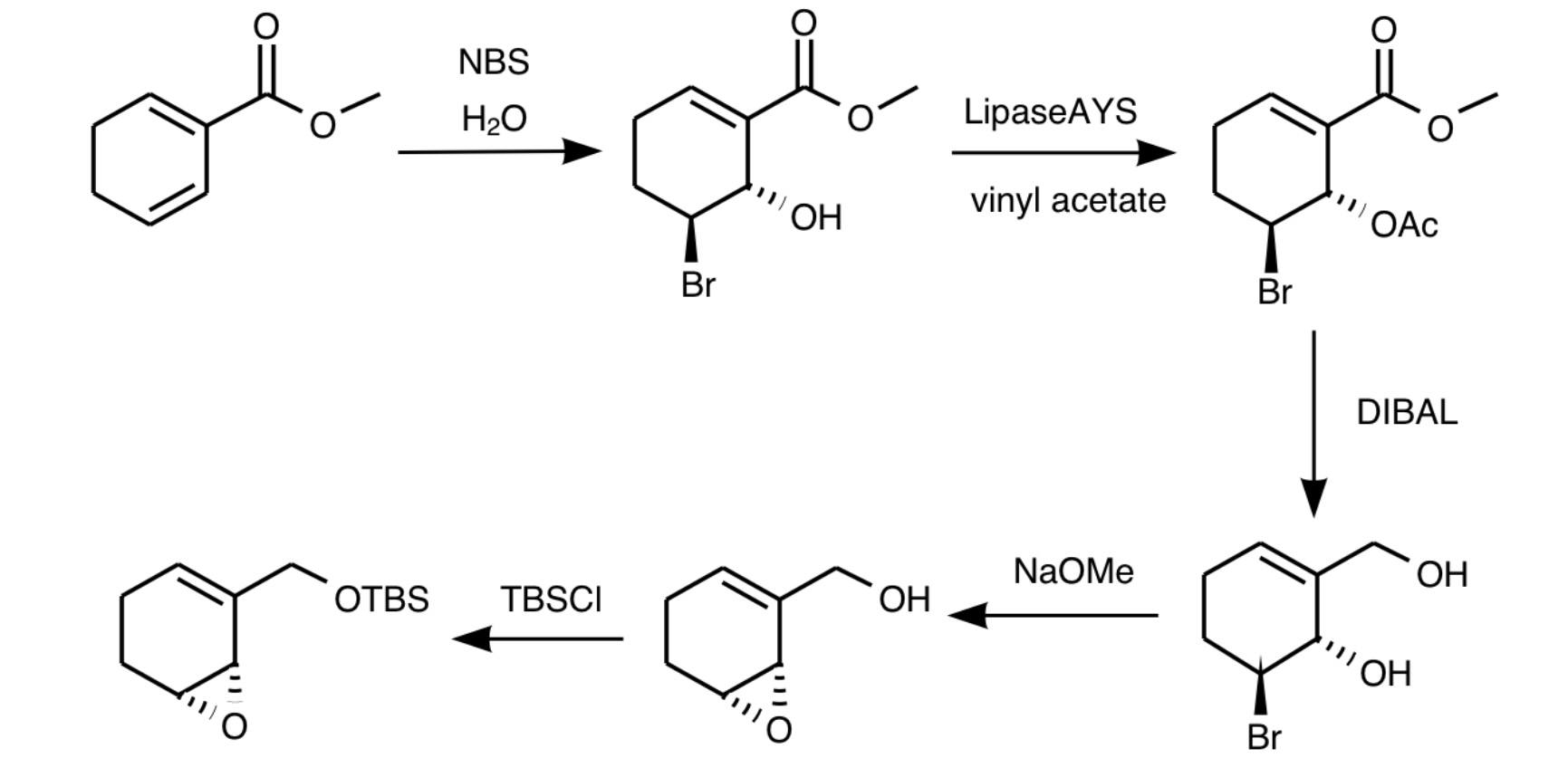
続いて1,3-シクロヘキサジエン体のC3位のオレフィンにNBSと水を反応させてブロモヒドリンを合成します。オレフィンがブロモカチオン三員中間体を生成し水がSN2的攻撃で付加するのでもちろんanti付加しますがこのときの水酸基が後のリパーゼによる酵素光学分割を受けます。水酸基が酢酸ビニルでアセチル化されたらDIBALでヒドリド還元します。ここでLAHを用いないのはオレフィンやブロモ基に対する官能基許容性の問題です。その後2価の水酸基を持ったブロモヒドリンが生成しフラン環とエポキシドの形成が競合しそうに思えますが実際はエポキシド形成が優先されます。理由は片方がアリルアルコールだからです。アリルアルコールはsp²炭素のπ電子が非局在化することによって骨格が安定化されて固くなり柔軟性を失うのです。最後にTBSClでアリルアルコールを保護してシクロヘキセンエポキシドアリルアルコール保護体を得ます。これを後にカップリングに用います。
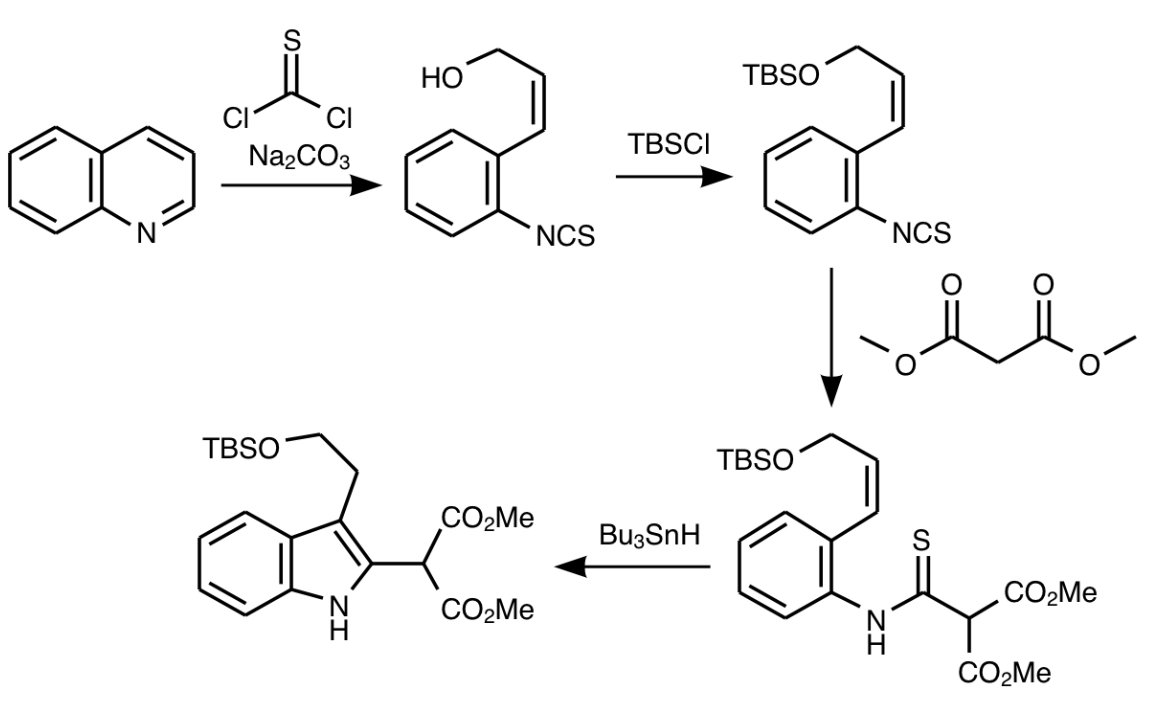
さて話を別の化合物に移しましょう。続いての反応出発物はキノリンです。ストリキニーネはインドールアルカロイドですからインドール骨格の構築が必要です。そのためにはキノリンをチオホスゲンで開環させてイソチオシアネートを得たのち水酸基をTBS保護してマロン酸ジメチルを付加させて福山インドール合成の前駆物質を合成しトリブチルスタンナンでインドール合成します。福山インドール合成ではキノリンから誘導されたイソチオシアネートから誘導したチオアミドとオレフィン二重結合が目印にラジカル的反応でインドールを形成します。
このインドールと先ほど作ったシクロヘキセンエポキシドアリルアルコール保護体とパラジウム触媒でクロスカップリングさせます。反応点は付加させたマロン酸ジメチルの活性メチレン基(CH)とシクロヘキセン上のアリル位です。カップリングのはずみでエポキシドは開環してアルコールになります。
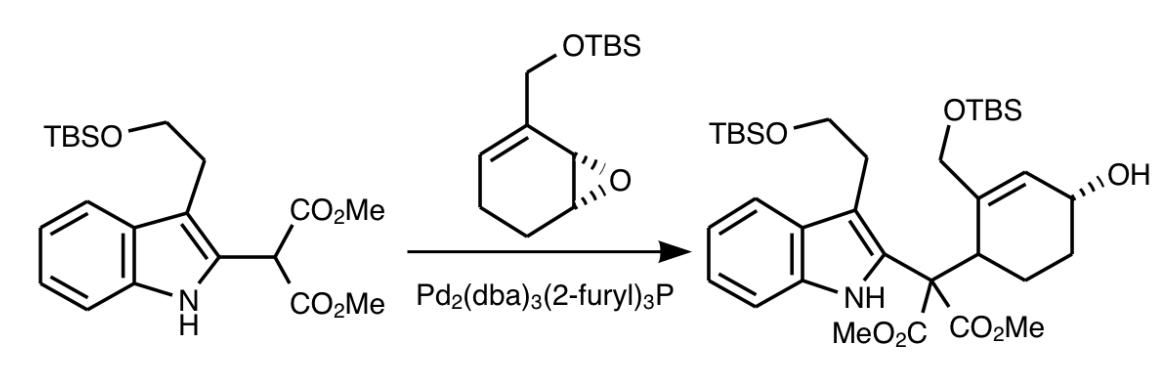
アルコールをMOMClで保護したのちヨウ化リチウムでKrapcho脱炭酸を行い2つのうち片方のメチルエステルを二酸化炭素として飛ばします。ちょうどマロン酸ジメチルが付加したような構造なのでこのような反応が可能です。その後インドールのNをBoc保護してTBSを脱保護します。N-Boc保護O-MOM保護ジオールインドール誘導体が得られます。
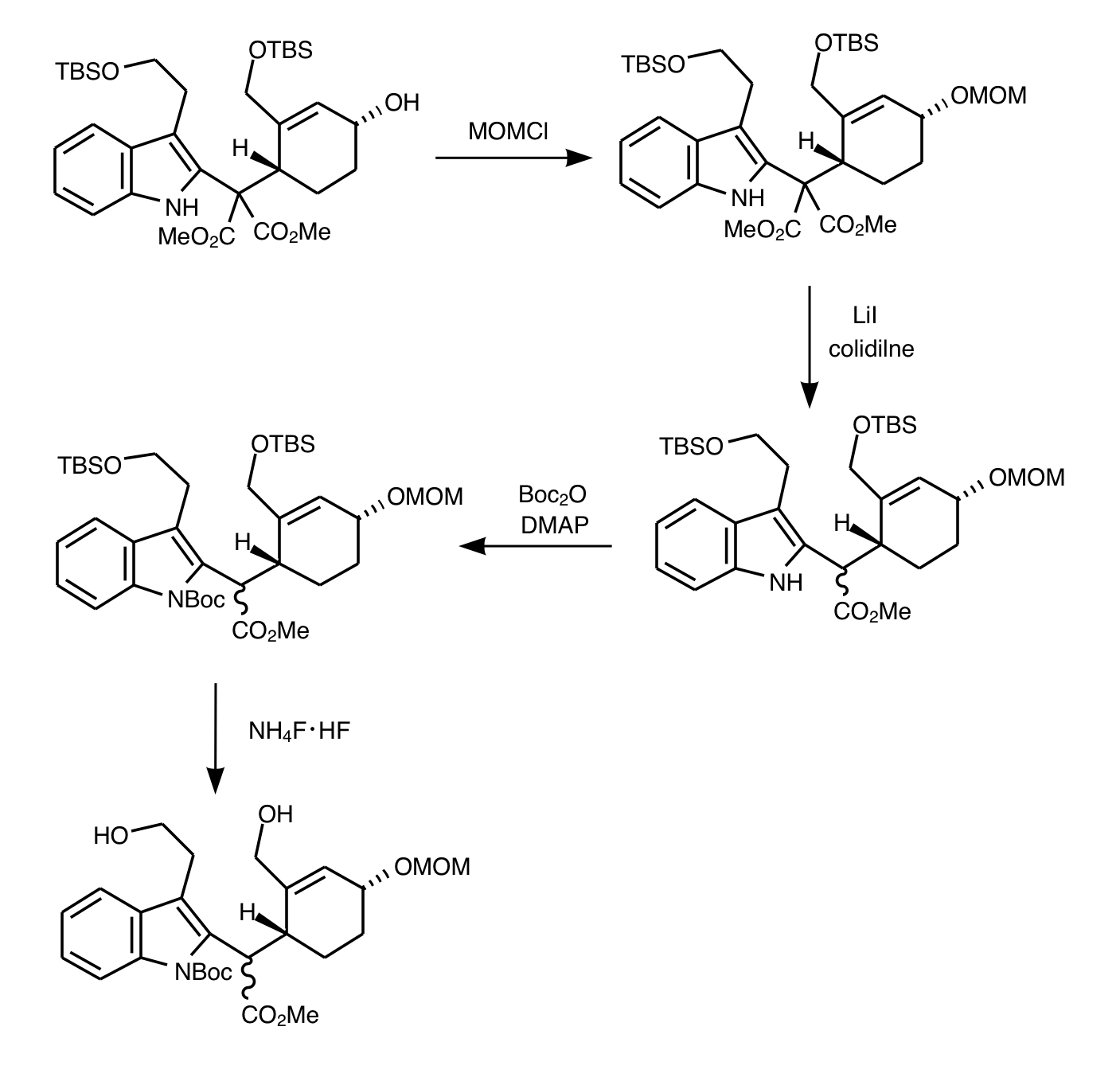
2つの水酸基から環状アミンを得たいのでここでノシルアミドを用いた福山アミン合成を行います。福山アミン合成はDEADとトリフェニルホスフィン存在下でノシル基とアルコール、もしくは塩基存在下でハロゲン化アルキル、を目印にして目的のアミンを得る方法です。今回は単純に環状二級アミンを得たいのでノシルアミド(NsNH₂)を用います。二つ生えてる水酸基で環化できるわけです。
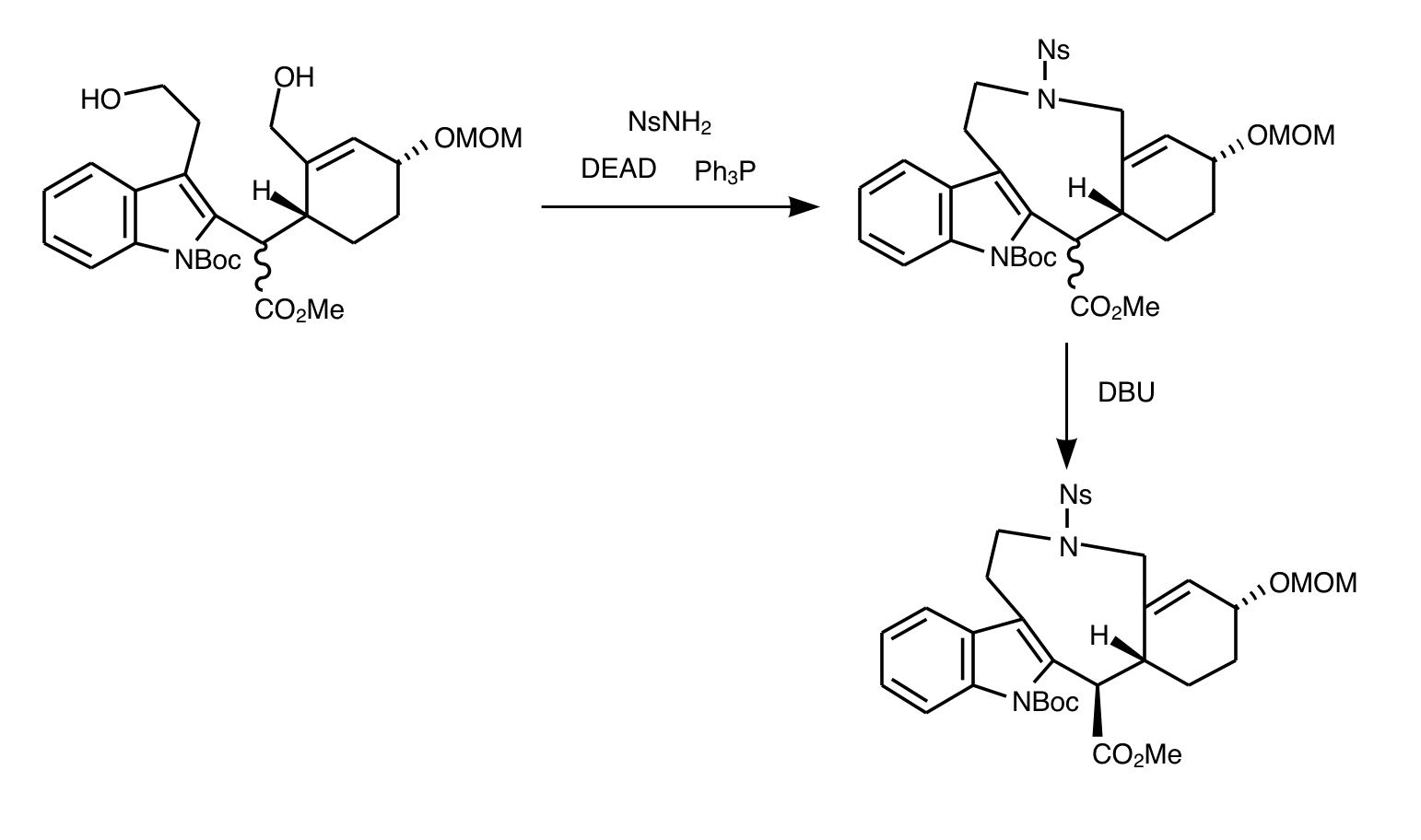
福山アミン合成による大環化で天然物の全合成反応たる九員環が導入できてしまいました。ここから縮環作業に入ります。まずメトキシメチルエーテルを脱保護して超原子価ヨウ素のペルヨージナンを用いたデス・マーチン酸化を行いアルコールをケトンにします。続いてαプロトンを引き抜いてからTMSOTfでエノラートを固定保護します。シリルエノールエーテルを一種のオレフィンと見てm-CPBAで酸化しα-ヒドロキシケトンを得ます。ここまでをRubottom酸化といいます。そこに酢酸鉛(Ⅳ)を作用させてカルボニルと水酸基の間をラジカル酸化開裂させてアルデヒドを得ます。
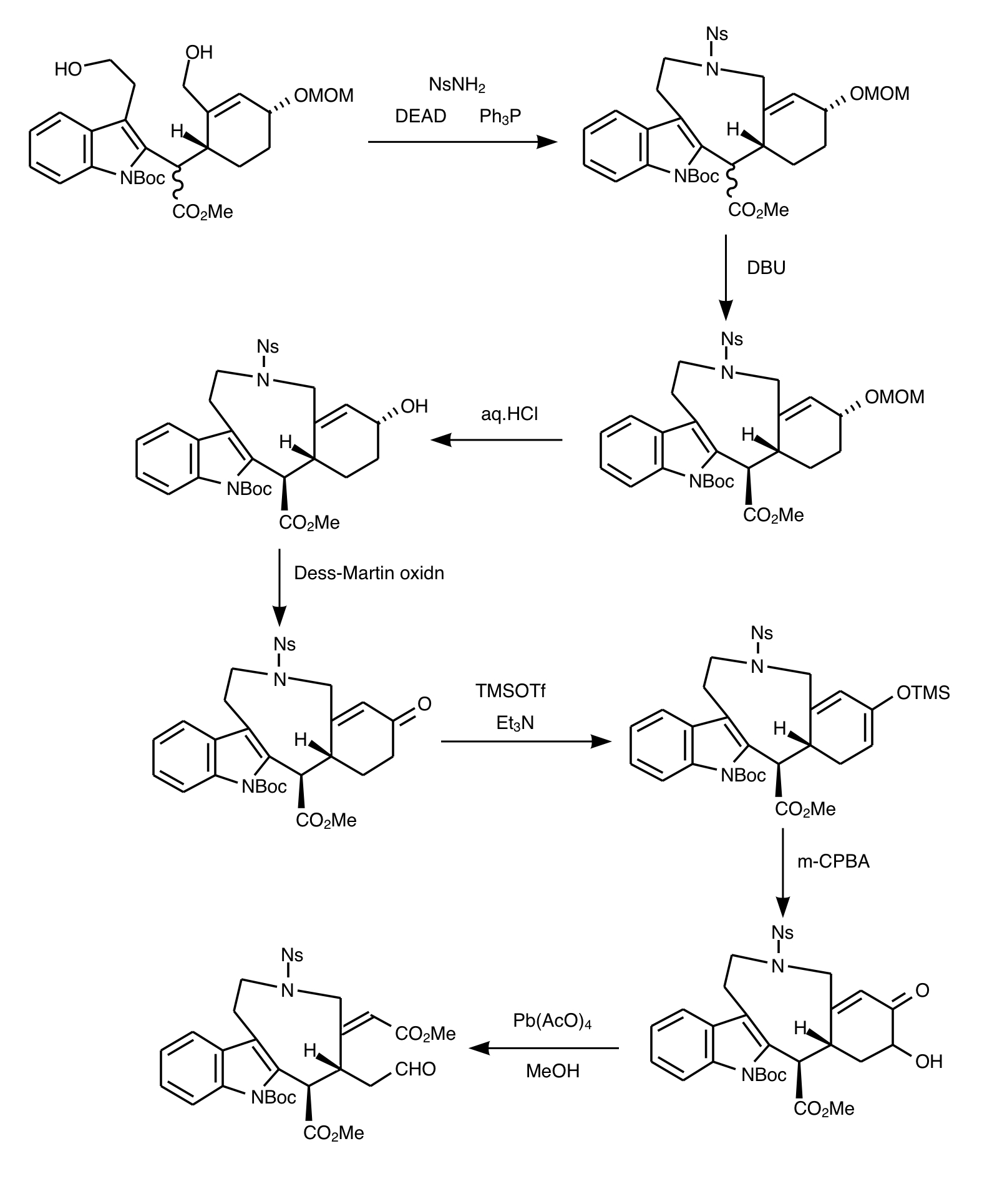
ここまで来たら縮環です。ノシルアミドをチオフェノールと塩基(炭酸セシウム)で脱保護して二級アミンにし、アルデヒドに求核付加させたのちイミン化させ、イミニウムが求電子剤となりインドールへ芳香族求電子置換反応を起こして環化します。続いて立体障害を利用したDIBAL還元で片方のメチルエステルをアリルアルコールに変換します。シアノ水素化ホウ素ナトリウムで電子不足なオレフィンにヒドリドを供与して単結合へ還元し、アリルアルコールによるDIBALでメチルエステルからアルデヒドへ変換されたカルボニルへの求核攻撃によって分子内環化で環状ヘミアセタールが生成します。
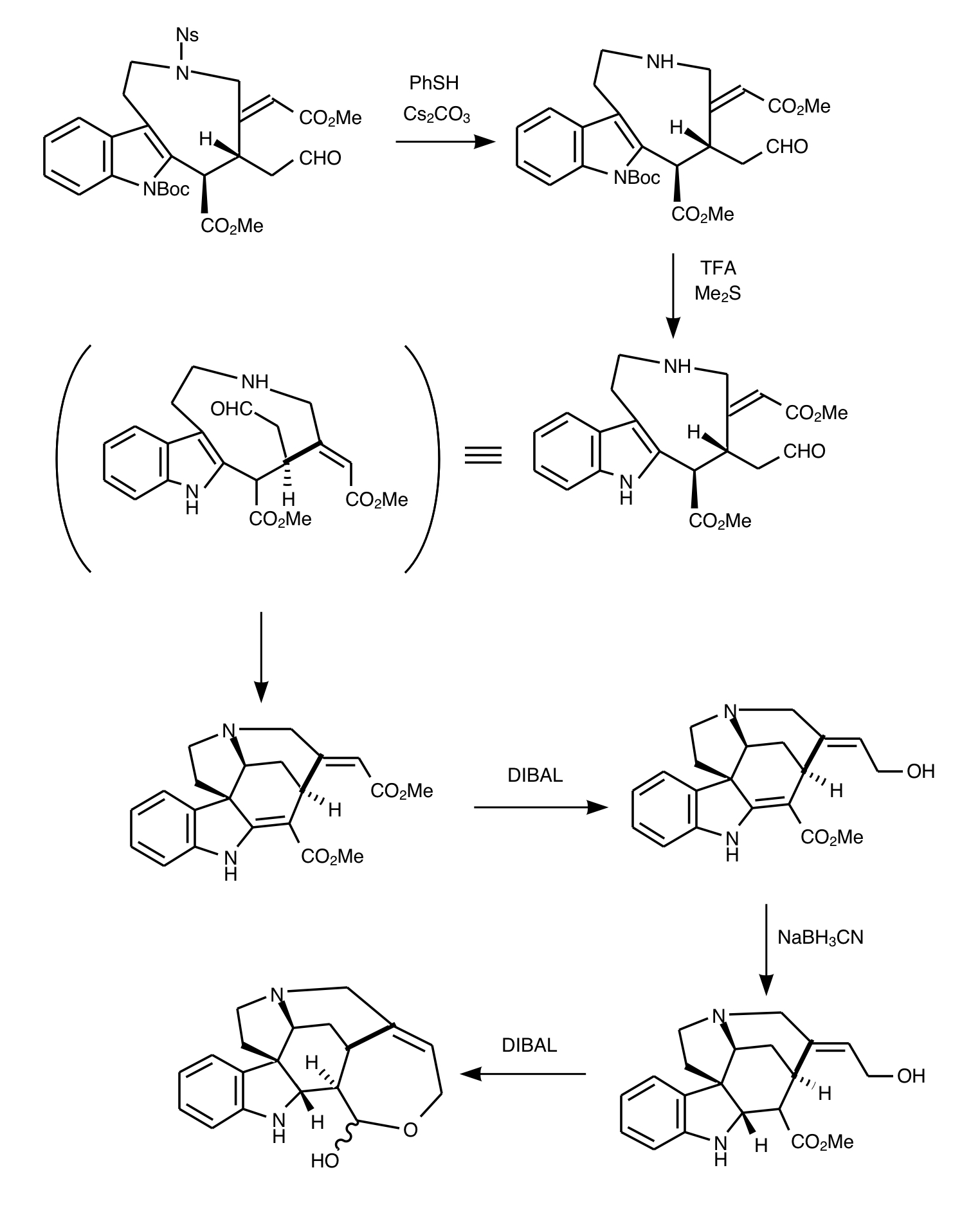
いよいよ最終段階です。マロン酸を無水酢酸でアセチル化して活性種を作りそれを基質に作用させてインドールのNとマロン酸アミドを形成させます。環状ヘミアセタールの水酸基が飛んだその際に互変異性でマロン酸の活性メチレン基が求核剤となり六員環を形成します。その後加熱により脱炭酸が起こりストリキニーネの完成です!
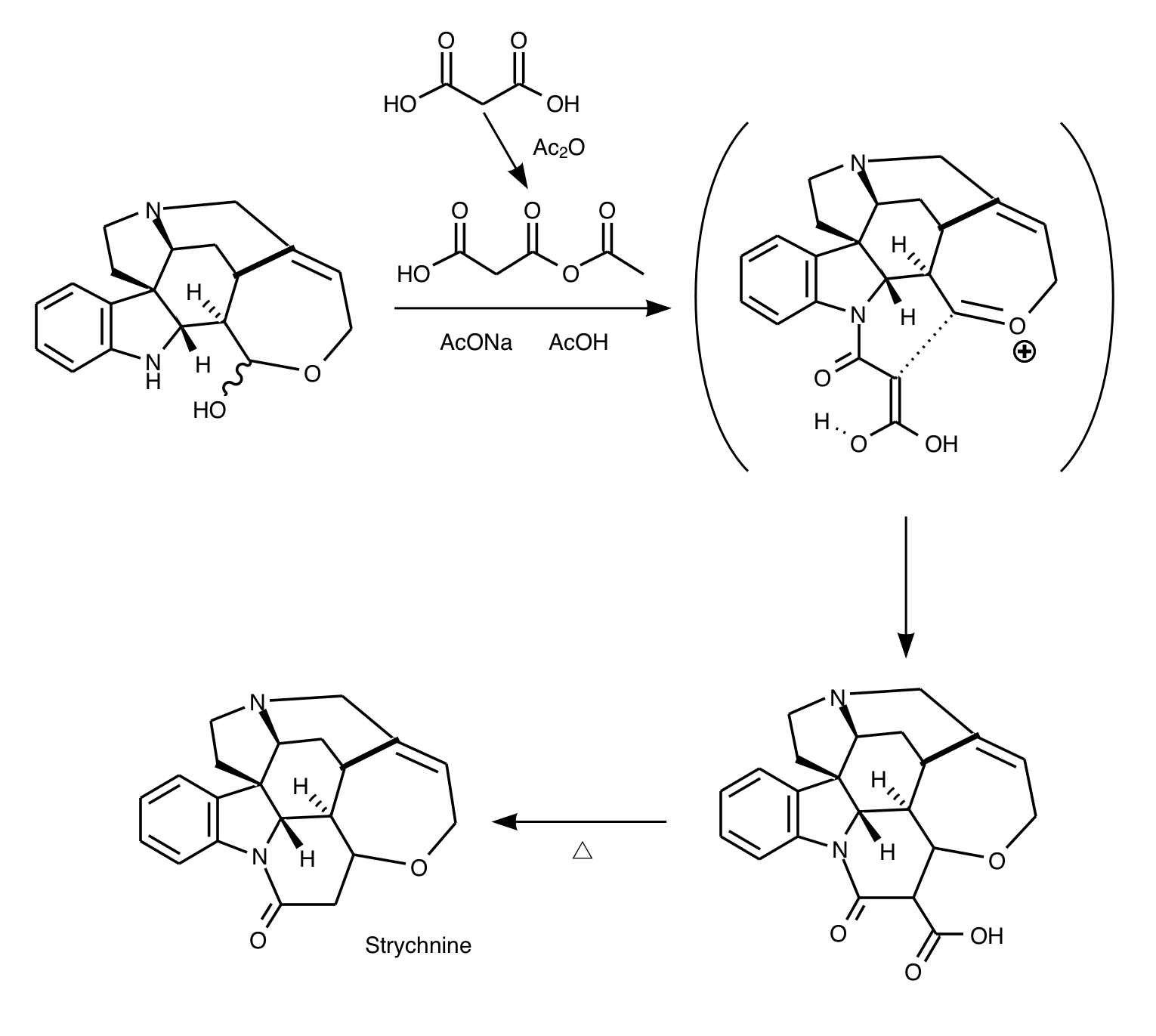
30ステップ近いスキームから見事に反応を駆使して美しく合成された経路だと感じます。日本人化学者の中の全合成の長、福山透の凄さがお分かりいただけたでしょうか。これを研究室でやれなんて言われたら気が狂ってしまいそうです。今回は有機合成化学専門の理工学部のメンバーに監修をしてもらってそれを書き下すという記事でした。それでは今回はこの辺で、次回までさようなら(次回あんのかコレ…)。
文・図: えざお
監修: NaLuRu
≪≪ 戻る
