前回の執筆から約3ヶ月が経過し、すっかり梅雨らしくなってきましたが、みなさまいかがお過ごしでしょうか。
自分は考えたネタを思いついたそばからセルフ棄却する日々をおくっておりました。
そんな激しいボツの嵐を潜り抜けたネタですが、今回の記事は“超初心者向け実験講座”です。前回も申し上げましたが、所長や他の精鋭の皆様と違い、自分は凡人。むつかしい話はよく分からないのでございます。
しかし凡人、ひらめきました。むつかしい話ができないからこそ、化学が苦手な人、分からない人にも親しみやすい記事が書けるのではないか?
ということで、超初心者向け実験講座、第1回はTLCの解説をします。TLCと言われて、「あー、あれね!」となる方は、おそらくこの記事から得られるものは何もないです。すみません。それくらい超初心者向けのことしか言いません。ご了承ください。
さて、ここまで残ってくださった皆様は、TLCのことは\"よくわかんないけど、アルファベットが3文字並んでる\"という認識でいらっしゃるでしょうか?
たしかに、TLCはアルファベットで表記されていますが、ゴツい機械もなんかよく分からん式も扱いません。むつかしくないのです。
TLCは、フルネームをThin Layer Chromatography といいます。
日本語では薄層クロマトグラフィーです。
はい、まだよく分からないですね。
要は薄っぺらい紙に液体を吸わせて色々調べるってことです。(語弊はある)
紙といっても、TLCで使うのはこんなやつで、TLCプレートとか、TLC板とかいいます。

TLCプレート
このTLC板はアニスアルデヒドで染色されていますが、本来は真っ白な板です。染色している理由ですが、有機化合物は大体無色透明とか真っ白なので、肉眼では結果が見えないこともよくあります。そのため、特定の化合物で呈色する試薬などによって可視化を行なっているわけです。
TLC板の説明に戻りますが、白い表面はちょっとザラザラしていて、裏は紙だったり、プラスチックだったり、アルミだったりします。大事なのは表面だけです。(人間みたいですね…)
表面のザラザラの正体はシリカゲルで、お菓子とかに入ってるアレを粉々にしたものが塗り固められています。
有機化合物は往々にしてこのシリカゲルとくっつきたがります。その理由を説明するためには「双極子モーメント」というものを理解してもらう必要があります。
双極子モーメントとは、電気陰性度の違いによって生じる電化の偏りに相当するベクトルのことですが、難しいことはよくわからんと思いますので、電気っぽい矢印とだけ思っといてください。
具体例を出して説明したいと思います。安息香酸とアセトフェノン、よく似た化合物ですが、カルボニル炭素(=Oがついている炭素)についている置換基がヒドロキシ基とメチル基で異なります。
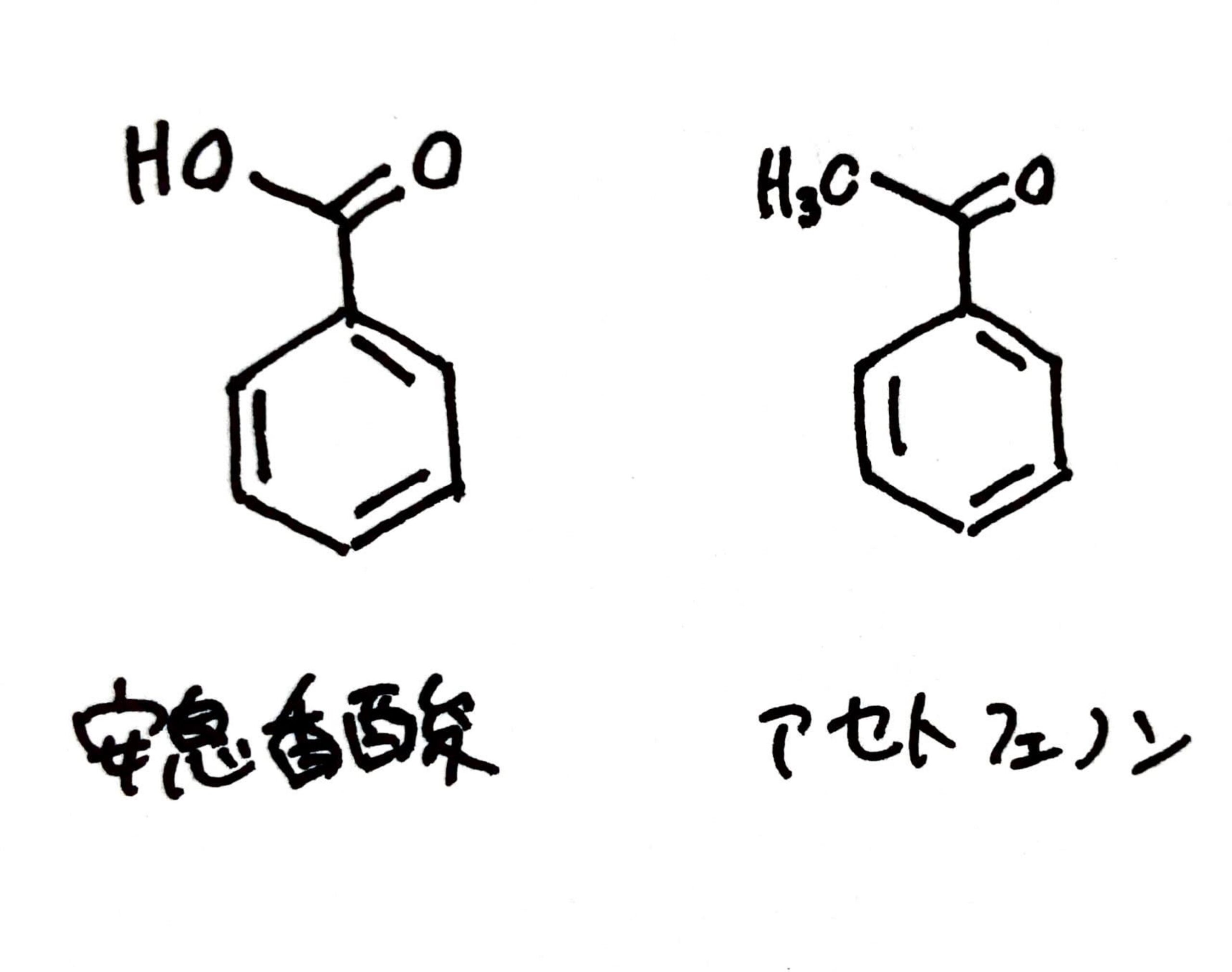
ここで注目したいのがカルボニル炭素を取り巻く環境。安息香酸では、カルボニル炭素はO2つとC1つと結合しています。アセトフェノンのカルボニル炭素ではO1つとC2つです。
電気陰性度はO>Cなので、電子を引っ張る力はOの方が大きいですね。これによってC-O(あるいはC=O)結合間の共有電子対はO原子上に偏って分布します。
別の言い方をすると結合性軌道におけるO原子軌道の寄与が大きいとも言えるのですが、軌道の話はまた今度にしましょう。
O原子が電子対を引きつけることによりδ-性を帯び(⇔ちょっとマイナスになる)、反対にC原子はδ+性を帯びます。こんなかんじです。
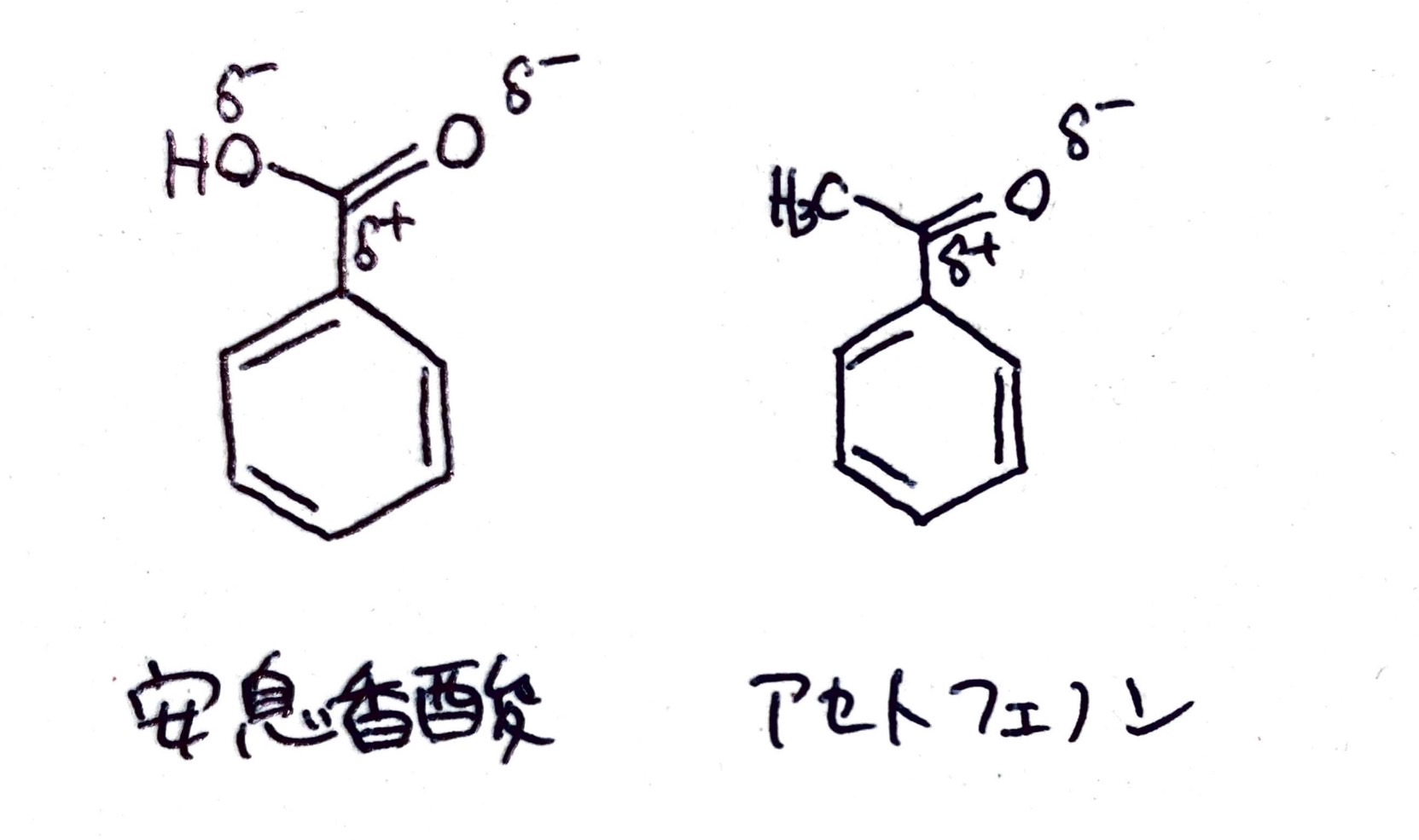
このように分子内で電荷の偏りが生じることを「分極」といいます。ではこの分極の様子を、+側から-側に矢印を引いて表すルールで表記してみましょう。
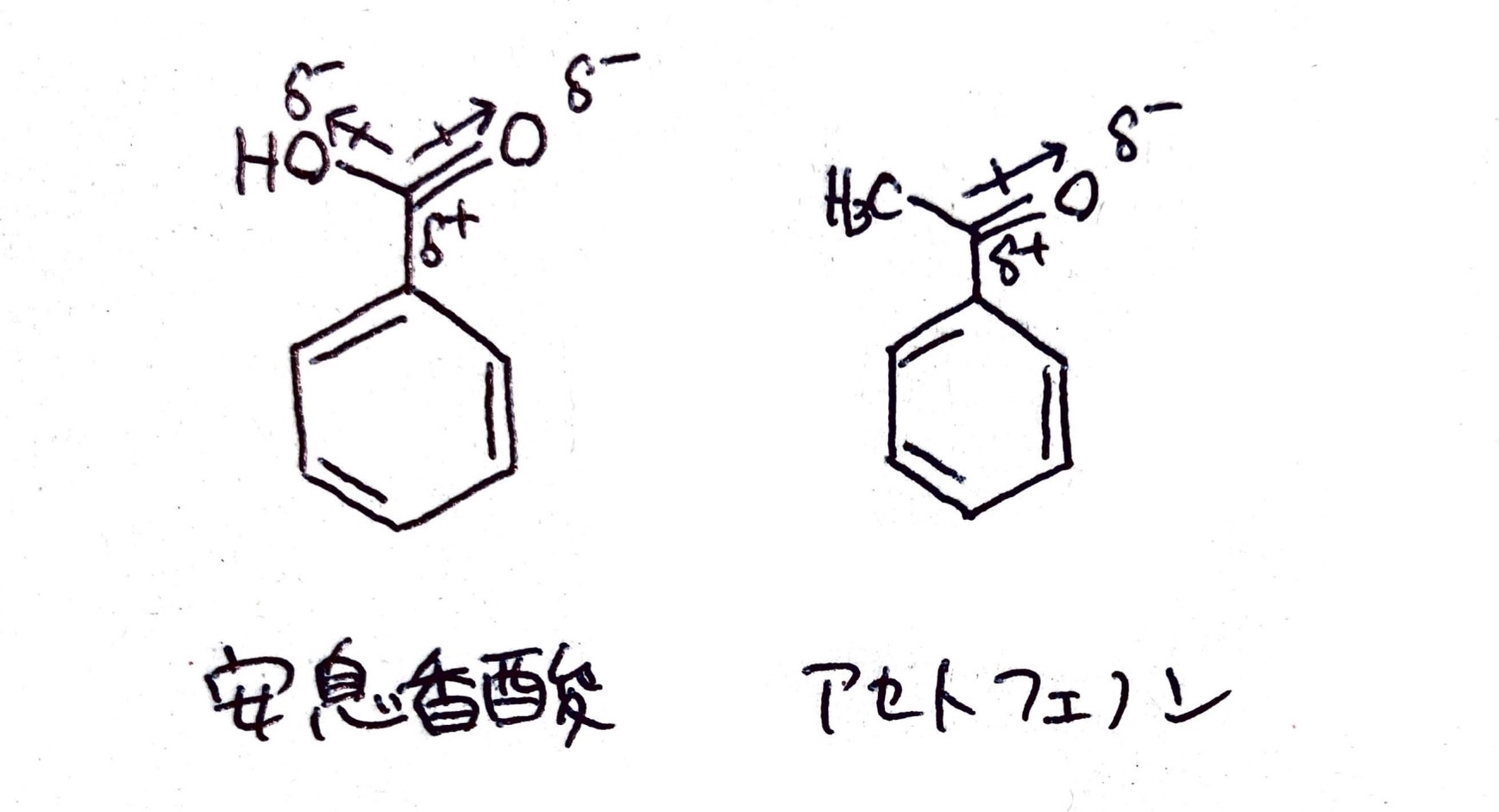
…どうでしょう?安息香酸の方はベクトルが2つ出ている分、カルボニル炭素がより強いδ+性を帯びている感じ、伝わりますでしょうか…?2つのO原子から電子対を引っ張られるわけですから、1つからしか引っ張られないよりももっと+になるのです。
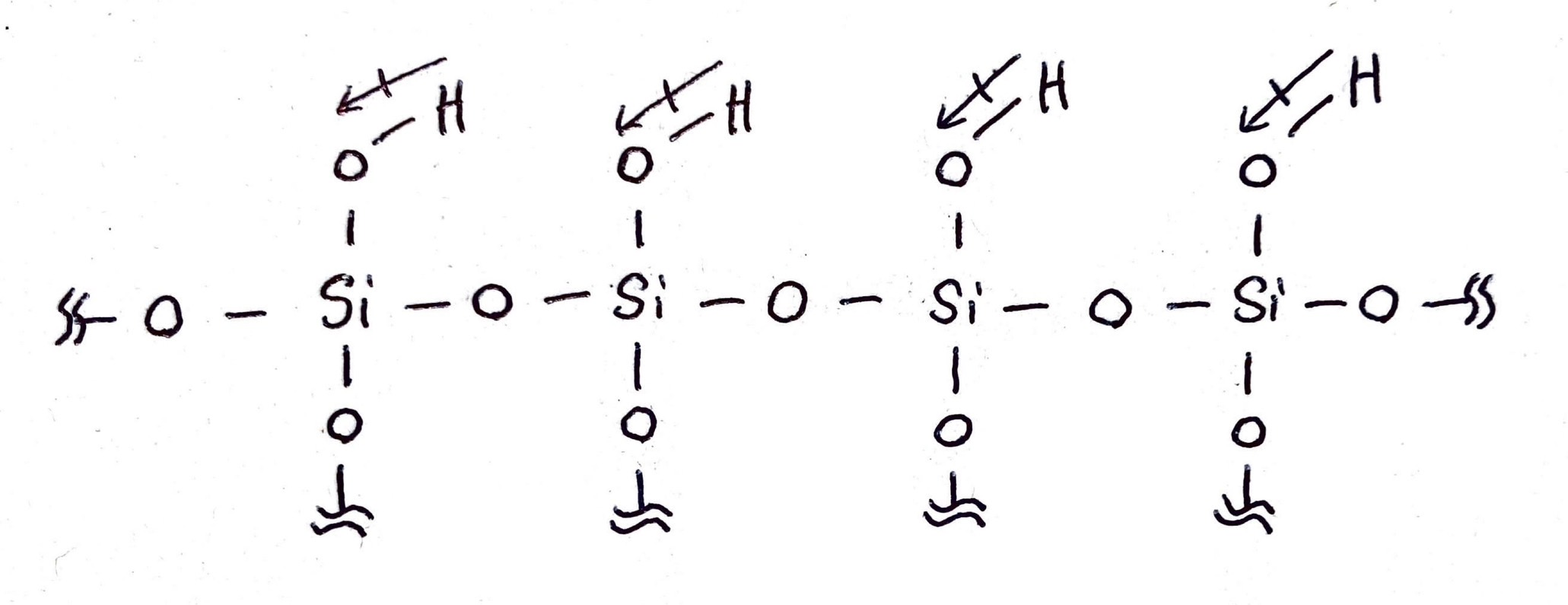
ちょっと前の話題に戻りますが、シリカゲルも同じように分極を起こします。まずシリカゲルの構造はざっくりとこんな感じ。

注目するのはケイ酸のヒドロキシ基部分。電気陰性度はO>Hなので、双極子モーメントはこのようになります。
みなさんご存知の通り+は-に、-は+に引かれ合うので、シリカゲルと先程の2つの化合物が出会うとこうなります。
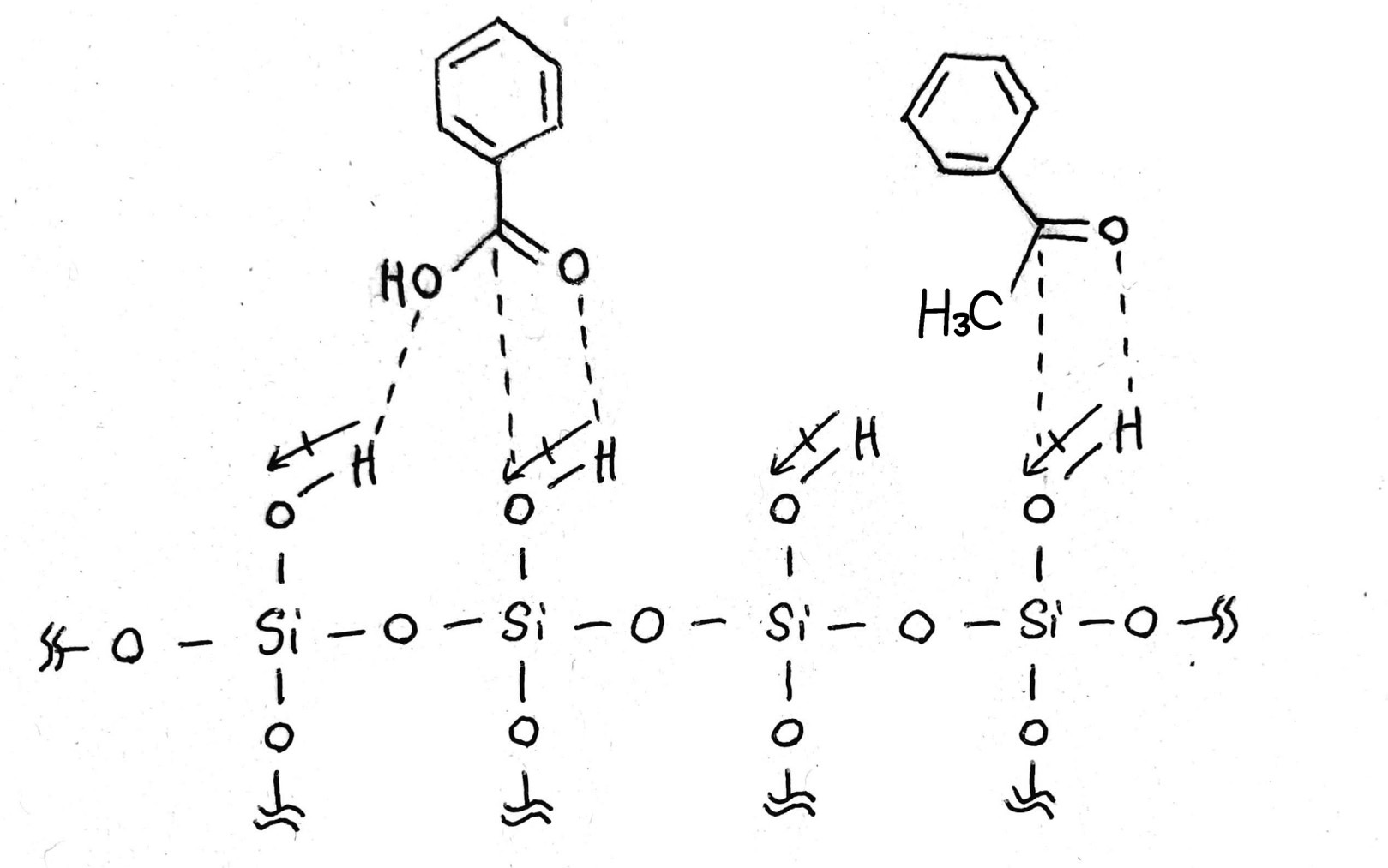
これが、大体の有機化合物がシリカゲルに引き付けられる理由。そして引きつけの強さは分極の度合い(双極子モーメントの大きさ)に由来します。
電気と磁気は違うので正しくはないのですが、あくまでイメージとしてお伝えします。シリカゲルが磁石ならば、安息香酸は強い磁石、アセトフェノンは弱い磁石といったところでしょう。強い磁石は強く付くからなかなか離れませんが、弱い磁石はくっついても簡単に動かすことができますよね?
安息香酸はシリカゲルに強く引き付けられるが、アセトフェノンは安息香酸ほど強くは引き付けられない、ということがわかってもらえたでしょうか?
では、シリカゲルが敷き詰められたTLC板の下の方にスタートの線をひいて、安息香酸とアセトフェノンを乗せ、上の方に向かってシリカゲル上を走らせたらどうなるでしょうか?
答えは、安息香酸はシリカゲルにくっつきやすいのでスタートに近いところで捕まって止まり、アセトフェノンはそれよりも進めるので上の方で止まる、です。
続けて問題、ここに安息香酸とアセトフェノンともう1つ、「安息香酸かアセトフェノンのどっちかだけど、どっちか忘れちゃった試料」があるとします。この3つをこんなふうにスタートの線において…
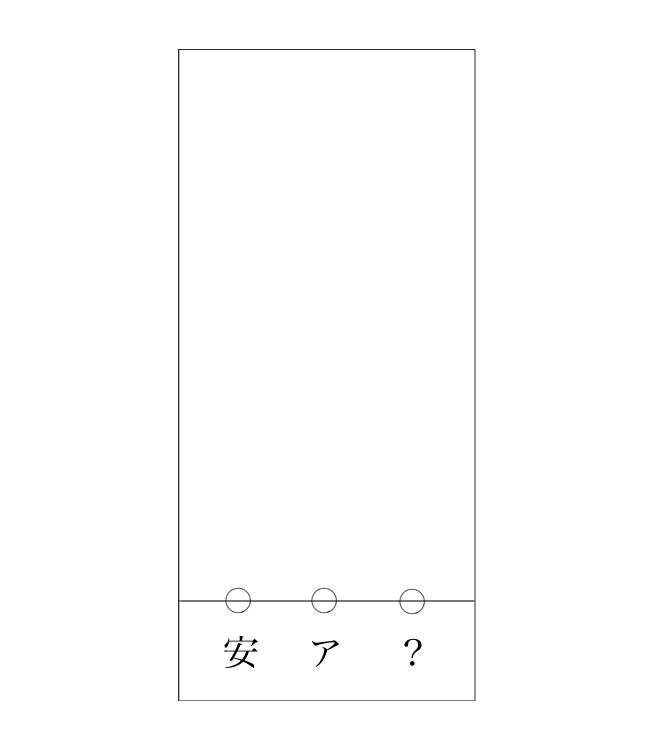
スタートさせたら、移動してこうなりました。
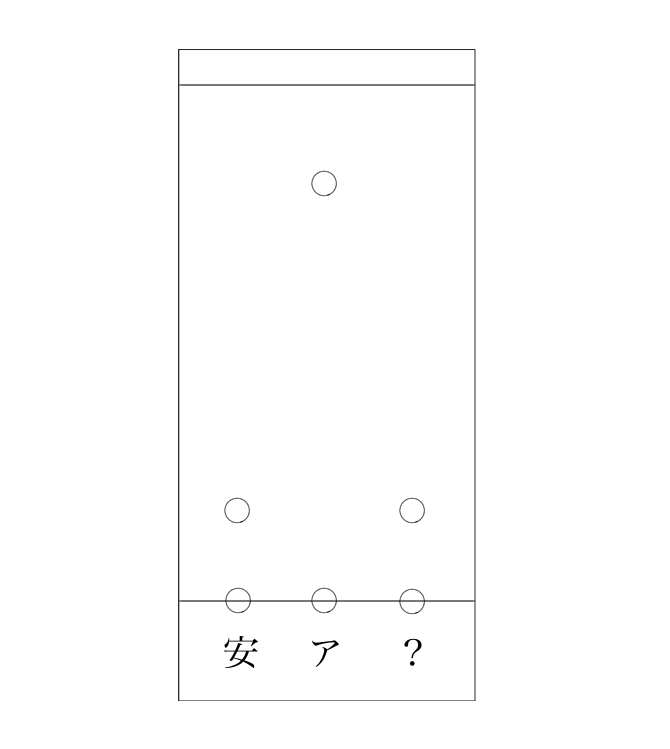
では、分からなかった試料は安息香酸とアセトフェノンのどちらだったでしょうか?
答えは安息香酸。試料のスポットが安息香酸と同じところまで進んでいるので、同じ物質だと分かります。
他にも、もしこんな結果になったら、
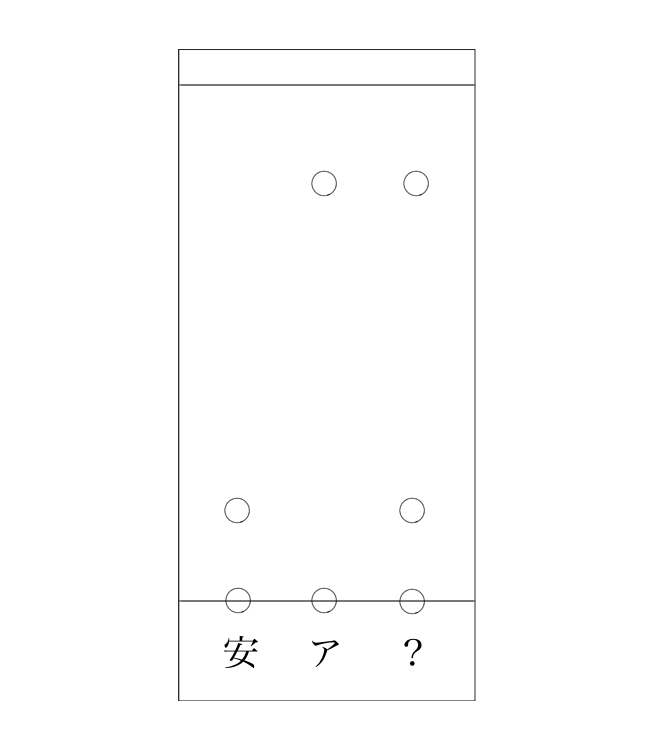
よく分からん試料は2つが混ざったモノだったことが分かるわけです。
こんなふうに、TLCは「う?ん、この白い粉、AかBのはずなんだけど、どっちだろう?」とか、「AをBにする反応をやったけど、ちゃんとBになっているかな?」というときに簡単に、安価にできる実験なのです。
では、ここから少し実験技能的な話をしていきます。
まず、試料をスタートラインに立たせることを、\"スポットする\"といいます。キャピラリーという細いガラス管を使って、チョンッと1滴よりも少なく乗せる操作です。乗せるとTLC板がすぐに吸って乾きます。濃度が低い試料を使うときなどは、乾いてからその上に重ねてスポットすることもあります。
次に、スタートラインから走らせることを\"展開する\"といいます。酢酸エチルやシクロヘキサンなどの溶媒を展開槽の下の方に少し入れて、TLC板を立てかけ、下の方から溶媒を吸い上げさせることで、スポットした試料も上に向かって進ませます。
終わらせるタイミングは、溶媒の吸い上げがTLC板の1番上に達する前です。いいですか、達する前です。数ミリくらい余白を残しておきます。
なぜなら、スポットした試料の移動は正確には\"止まる\"わけではないからです。\"進む速さ\"が速いか遅いかで分けているので、途中で止めずに放っておくと速さに関わらずご指摘をいただきました。スポットは溶媒につられて移動しているので、溶媒がゴールして動かなくなると、スポットも動かなくなります。なので、1番上まで吸わせたタイミングで取り出す手法もあるようです。
ただし、長時間放置すると周りに溶けてしまってスポットが消失することになるので、やはり放置はおすすめできません。
しかしながら、我々化学系の中にもうっかり放置しちゃう人が一定数いるんですねぇ、こうなったらもうやり直すしかないです。
とはいえ、ちゃんと終わりまで見張っておけばとっても便利な手法なので、ケミストの卵ならしっかり使いこなしていきたいところですね!(というより、使えないともはや何もできない…)
そういえば、さっき展開したTLCどうなったかなっと……あっ…
超初心者向け実験講座 ※6/24訂正箇所あり
≪≪ 戻る
