先日、ホームセンターに買い物に行った際にこんなものを見つけました。

今回はこの肥料から硫酸カリウムを再結晶し、さらに入浴剤のエプソムソルトと反応させてタットン塩という複塩の結晶をつくろうと思います。
◆ 硫酸加里について
硫酸加里とは硫酸カリウム K2SO4 の略称で、植物へのカリウム源の肥料として売られているようです。
今回購入したものは顆粒状で結晶性ではなく、不純物が多いと推測されます。

◆ エプソムソルト
エプソムソルトは入浴剤として使用されるマグネシウムの硫酸塩で、正しくは硫酸マグネシウム七水和物 MgSO4・7H2Oという無色透明の物質です。

今回使用したものは東急ハンズで購入しました。こちらは無色透明の結晶状であり、純度が高そうですので、そのまま反応に使えそうです。
注意点としては、不純物である香料が混ざっていると失敗する恐れがあるので、無香料のものを選びましょう。

<実験>
◆ 硫酸カリウムの再結晶
① 肥料の硫酸加里 (60 g) を秤量します。溶かしやすくするために、袋に入れて木製のハンマーで粉砕を試みたのですが、意外にも硬くて袋が破れそうだったので止めました。

② 熱湯 (300 mL) を加えて攪拌します。見た目通り不純物が多く、着色した物が溶け残っています。

③ ろ過して不純物を除去します。ろ過前は溶液が着色していましたが、ろ過後はほとんど着色していません。これならいけそうです!

④ 濾液を静置して室温まで冷やします。室温まで冷えたら冷蔵庫に入れて更に冷却します。
無色透明の綺麗な結晶がすぐに析出しました。

⑤ 析出した結晶をろ過して集めます。


25.4 gの硫酸カリウムを得ることができました。
◆ タットン塩 K2[Mg(H2O)6](SO4)2の合成
① 再結晶した硫酸カリウム (8.5 g) を水 (60 mL) に加え、沸騰させて完全に溶解させます。

② 硫酸カリウムが溶解したらエプソムソルト (24 g) をゆっくり加えます。いきなり大量に加えると吹きこぼれて危険ですので、必ず少しずつ加えましょう!
③ しばらく攪拌してエプソムソルトが溶解したら、そのまま熱ろ過します。濾液を受けるガラス容器は事前に温めておきましょう!熱い濾液が加わった時に割れるリスクを下げることができます。

④ 室温まで放冷し、更に冷蔵庫に入れて結晶を析出させます。硫酸カリウムとはまた別の形をした無色透明の結晶が析出しました!
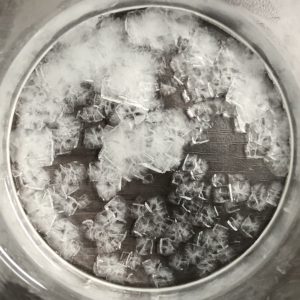
⑤ 析出した結晶をろ過して集めます。綺麗ですね!!


※今回の反応を化学反応式で書くと下記のようになります。
K2SO4 + MgSO4・7H2O → K2[Mg(H2O)6](SO4)2 + H2O
つまり硫酸カリウムと硫酸マグネシウムが1:1で反応する訳です。ところが今回の実験で使用した原料の物質量を計算するとK2SO4:MgSO4・7H2O = 1:2となっています。これはK2SO4の溶解度が目的物に対して低いため、1:1で混ぜると先にK2SO4が析出してしまいます。そこでMgSO4を過剰に加えることで目的物のタットン塩を優先的に析出させています。ちなみに下記のような形の結晶もタットン塩ではなく硫酸カリウムなので注意しましょう。

<タットン塩について>
説明が遅くなりましたが、今回つくったタットン塩に関して説明します。タットン塩 (tutton’s salt)とはMI2[MII(H2O)6](SO4)2 の式で表される硫酸塩の複塩です。ミョウバンと同じく硫酸塩の複塩ですが、1価の陽イオンMI 2つと2価の陽イオンのアクア錯体 [MII(H2O)6] 1つとの復塩となっています。その種類はとても豊富でwikiには非常に多数のタットン塩が記載されています。中でも有名なものが1価の陽イオンとしてアンモニウムイオンNH4+を用いたものと、今回のK+を使用したものになります。また、2価の陽イオンのアクア錯体として第4周期の遷移金属元素 (Mn、Fe、Co、Ni、Cu) を使用できることに加え、ミョウバンとクロムミョウバンのように混晶をつくることができるため、非常に様々な色合いの結晶をつくることができます!
MIとしてアンモニウムイオンを使用した種々のタットン塩については合成経験があるため、こちらに関して写真と簡単な説明を下記に記載します。
◆ (NH4)2[Mn(H2O)6](SO4)2
薄ピンク色の結晶。硫酸アンモニウムと硫酸マンガンの高温飽和水溶液を1:1のモル比で混合し、冷却すると得られる。
溶解度が他のタットン塩に比べて大きく、20 ℃の水100 mlに少なくとも70 g溶ける。

◆ (NH4)2[Fe(H2O)6](SO4)2
NH4-Feのタットン塩はモール塩と呼ばれる。薄緑色の結晶。水に溶かすと空気酸化を受けやすい。特に加熱はNG。希硫酸を加えて強酸性にしたり、アスコルビン酸 (ビタミンC) を加えて溶液を還元性にすることである程度防ぐことができるが、手間がかかり合成や結晶づくりはおススメできない。

◆ (NH4)2[Co(H2O)6](SO4)2
ややオレンジがかった赤色の結晶。硫酸アンモニウムと硫酸コバルトの高温飽和水溶液を1:1のモル比で混合し、冷却すると得られる。溶解度は23 g/100 ml (20 ℃)。

◆ (NH4)2[Ni(H2O)6](SO4)2
緑色の結晶。硫酸アンモニウムと硫酸ニッケルの高温飽和水溶液を1:1のモル比で混合し、冷却すると得られる。他のタットン塩とは異なり、原料の溶解度に対してタットン塩の溶解度が低いため、混ぜるとすぐに析出する、溶解度は10 g/100 ml (20 ℃)。


◆ (NH4)2[Mg(H2O)6](SO4)2
無色透明の結晶。硫酸アンモニウムと硫酸マグネシウムの高温飽和水溶液を1:1のモル比で混合し、冷却すると得られる。溶解度は28 g/100 ml (20 ℃)。

Mgのタットン塩は無色透明のため、有色のタットン塩と混ぜることで色を薄めに調整することができます。

CoとMgの混晶タットン塩 (Co:Mg=1:5)
<おわりに>
いかがでしたでしょうか。
今回は、身近にはあるものの、結晶づくりの実験としてはあまり用いられない物にスポットを当ててみました。
また、身近な物どうしを反応させて、別の物質の結晶をつくる実験も比較的珍しいかと思います。
先にも述べましたが、タットン塩は非常にたくさんの種類があり、
タットン塩どうしで混晶もつくることができるため、結晶づくりの魅力が大いにあると思います!
皆さんも是非、様々なタットン塩づくりにチャレンジしてみてください!!
≪≪ 戻る
