まだまだ暑い日が続きますが今回はそんな暑さに打つ勝つべく自室で氷点下の物体をつくりだそうと思います。冷凍庫的なモノでなく、氷と常温の物質だけで電気を使わずにです。その方法とは、氷の凝固点降下を利用します。
凝固点降下とは、不揮発性の溶質を溶かした溶液の凝固点は純粋な溶媒の凝固点より低くなる現象の事です。氷に塩をかけると0℃以下になることは聞いたことがあると思います。それです。よく家庭でアイスクリーム作りに使われるやつです。その現象は、凝固点降下により氷は溶けて液体になりますが、そのときに氷の融解熱(固体→液体にするのに必要な熱量)である334kJ/kg分周囲から熱を吸収することで起こります。式:H₂O(S)=H₂O(L)-334kJ(Sは固体、Lは液体の意。本来熱化学方程式の熱量は吸熱なら符号は+ですが今回は高校範囲の定義にしたがっているため-にしています。)
では、そもそも凝固点降下はなぜ起こるのでしょうか。溶媒の凝固点では、下の模式図のように固体と液体が共存しており分子レベルで見ると液→固になる分子と固→液になる分子が存在します。つまり、平衡になっており、特にこのような場合を「固液平衡」と言います。式:H₂O(S)⇄H₂O(L)

純粋な溶媒のみの場合、fとmの数は等しくなります。しかし、塩などの溶質が溶けると、fの濃度は減少します。mの数は変わらないためどんどん固体が融けていきます。平衡の式でH₂O(S)の濃度が減少すればルシャトリエの原理より、平衡は右側(融ける反応側)に偏ることが分かると思います。以上が詳しい原理です。
ただの食塩でも理想的な比で混ぜれば-20℃程度までは下げれるらしいのですが、今回はもっと低温を目指します。そのために使用するのは塩化カルシウム6水和物です。塩化カルシウム6水和物と砕いた氷を質量比1.44:1で混合すると-54.9℃まで下がるらしいので頑張ってみます。しかし塩化カルシウムが水に溶ける反応は発熱反応として知られています。そのためいくら凝固点降下があっても-何十℃まで下げるのは無理があるのでは?と思いますが、実は発熱を伴うのは無水物を溶解させたときの話です。すなわち、塩化カルシウムの水和熱自体は発熱なのですが6水和物の溶解熱は吸熱なのです。したがって凝固点降下+溶解時の吸熱反応で冷やすことが出来ます。
物質を反応(溶解)させるポイントとして、物質の表面積はとても重要になってきます。今回は素早く塩化カルシウムによって氷を溶かしてもらわないといけないのでどちらも細かい状態(表面積が大きい状態)が理想です。ですが今回扱う両物質は後述する理由により細かくするのに工夫を必要とします。氷を細かくしにくいのは分かりますね。ちんたら乳鉢やハンマーなどで砕いていては溶けてしまいます。そこで今回は氷を砕くのにどこのご家庭にもあるモノを使います。そう、氷を細かくするといったらかき氷器です!そして、塩化カルシウムの方ですが、こちらは常温でも構わないのですが、あまり長く空気にさらすのは好ましくありません。その理由は2つです。1つは、塩化カルシウムには強い吸湿性と潮解性があるからです。潮解性とは空気中の水分によって溶解してしまう現象のことです。2つ目は空気中の二酸化炭素と反応し不溶性の炭酸カルシウムを生じてしまうからです。したがって塩化カルシウムは空気になるべく触れないように、適当な袋に包んだ状態で砕きます。
使用試薬
・塩化カルシウム無水物(融雪剤)
・氷
使用器具
・ビーカー
・温度計(マイナスの温度を測れるもの)
・電子天秤
・薬さじ
・金槌
実験操作
① 融雪剤を飽和するまで200mLの水に溶かします。不純物の影響でやや黄色みがかった溶液になりました。

② 適当な容器に移し冷凍庫に入れます。急冷することで細かい結晶を析出させます。(いや冷凍庫使うんかいってなりますがここはノーカン())
③ 細かい結晶が析出する予定でしたが、写真のようにほぼ全て結晶になってしまいました。このままある程度砕いたら切り開き結晶を取り出し、水分を軽く引き取ります。


④ 素早く袋に包み結晶をさらに砕きます。

⑤ 砕いた結晶を取り出し、手際よくビーカーに入れ秤量します。

⑥ ⑤の質量を1.44で割った分のかき氷を素早く入れます。(ここのかき氷器の調整が難しい)
⑦ みるみる氷が溶けていくのでかき混ぜながらデジタル温度計で温度を測ります。

以下に結果の表を示します。
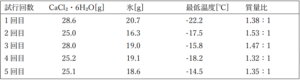
質量比が最も理想に近い3回目ではなく1回目が最低温度となりました。どうやらこの辺りの温度では質量比より反応スケールの方が重要そうです。ちなみに食塩11.2gに氷38.8gを混ぜたところ-15.8℃まで下がりました。一応食塩の場合の理論値も実測値の温度も下回る事は出来ましたが、イマイチです。
-22.2℃程度で止まってしまった原因ですが、使用後のビーカーの中を見てみると
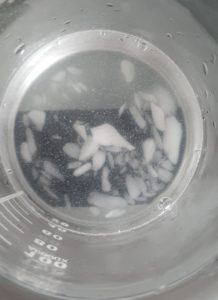
CaCl₂•6H₂Oの結晶片が残っています。砕くのが足りていなかったのでしょう。また外側には霜が付いていました。
改善点としては
・もう少し細かくする
・さらに大きいスケールで行う
・断熱性の高い容器を使う
などが挙げられます。
またいつかリベンジしてみたいです。
簡単に出来るので是非みなさんもやってみてください。結果を下回ることができたら教えてください。
それではまた次回。読んでくださりありがとうございました。
≪≪ 戻る
