今回はレモンからクエン酸を抽出したいと思います。ご存じの通りクエン酸は多くの柑橘類に含まれておりその酸っぱさの元になっています。下の分子構造を見ていただければ分かりますがクエン酸は3つのカルボキシ基(-COOH)と1つのヒドロキシ基(-OH)を持っています。
カルボキシ基が酸味を感じさせ、ヒドロキシ基がわずかに甘みを感じさせます。そのため爽やかな酸味を有し、酸味料としていたるところで使用されています。
クエン酸の物性情報
化学式:C₆H₈O₇ 分子量:192.13 融点:153℃(一水和物は100℃) 分解点:175℃ 溶解度:59.2g/100g H₂O(25℃)
レモンには1個あたり約4gのクエン酸が含まれていますが、今回使用したのが小さめのを二つなので計6.0gとして計算します。そしてそれだけだと少ないので市販のレモン果汁(ポ○カレモン)も使います。それには15mLあたり950mg含まれているので70mL中に約4.4g含まれています。したがって理論収量は10.4gです。
次に原理を説明します。下にフローチャートを示しておきます。
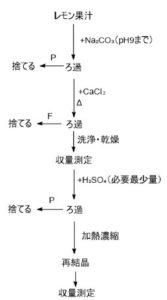
Fはろ液、Pは沈殿、Δは加熱を表します。
レモン果汁にNa₂CO₃を加えることで不純物を沈殿させるとともに、クエン酸をナトリウム塩に変えます。ろ過することで不溶性の固体不純物を除き、ろ液はクエン酸ナトリウム溶液となります。そしてCaCl₂を加えることでクエン酸カルシウムとして沈殿させます。このろ過で水溶性の不純物を除きます。続いて希硫酸を加え、弱酸遊離反応によってクエン酸を遊離させます。ろ過で硫酸カルシウムを除き、その後の再結晶でさらに純度を上げます。以上が全体的なプロセスです。
それでは実験していきましょう!
使用試薬
・レモン果実・ポッカレモン
・炭酸ナトリウム
・塩化カルシウム
・希硫酸(10%)
使用器具
・ビーカー・漏斗
・ろ紙
・加熱器具
・電子天秤
・万能pH試験紙
操作
※手袋、保護メガネなど身を守るものを必要に応じて必ず着用すること。① レモンから、果汁を搾り取ります。カスが多かったので一度ろ過しました。


ポッカレモンも70mL加えます。部屋がレモンの良い匂いになりました。

もちろんこのときはまだ強い酸性です。
② 炭酸ナトリウムをpHが約9になるまで加えます。このとき二酸化炭素の泡が発生するのであふれないように気をつけてください。

ちなみに中和の最中がもっともレモンの爽やかな良い匂いが強くなりました。泡が弾けたことで溶液がわずかに飛散したこともありますがおそらくpHが上がったことで溶けていた匂い成分が揮発してきたのではないかと思います。中和が完了した後の溶液は少し不快な臭いでした。色も淡黄色から橙色へと濃くなりました。
③ 再び不溶物をろ過し、加熱しながらろ液に塩化カルシウム水溶液(過剰量)を加えます。完全に沈殿させるため必要量の2倍程度に当たる42.4gを加えました。

予想よりモコモコした。 pic.twitter.com/QicdiZuCZL
◆応化くまく◆ (@Chem_Eme) August 19, 2021

デカンテーションのために静置してたらプリンみたいな色合いになりました。
④ 発生した沈殿をろ過し水洗したら沈殿をあらかた乾燥させ、収量を測定します。(ろ液は捨てる)収量は39.5gより10.12gの硫酸が必要なのですが後述する理由により10%希硫酸約90mLを加熱しながら加えます。
⑤ よく混ぜたら沈殿をろ過、洗浄し洗液ごと溶液をビーカーにとります。(沈殿は捨てる)

やっぱり若干黄色みは残ってしまう......
⑥ 加熱濃縮した後放冷し析出した結晶を得ます。

⑦ 収量を測定し収率を決定します。得られた結晶はこのような針状結晶でした。

収量は1.09gでしたので収率は10.5%です。収率が低い理由は④で未反応のクエン酸カルシウムが残っていること、⑤で沈殿の洗浄が不十分であったことが挙げられます。
以上で操作は完了です。注意点として、②、③は完全に反応させるため過剰量加えても問題ありませんが、⑥の希硫酸は必要最少量より少なめにするのをおすすめします。硫酸が残っているのに加熱濃縮してしまうと硫酸の濃度が上がり危険です。また気になった点として③でろ過したにもかかわらずろ液が清澄でない場合があります。原因はおそらく皮を強く搾り過ぎたことで果皮に含まれる油脂類がコンタミしてしまったのでしょう。それがエマルションになっているのだと考えられます。レモン絞り器を適切に使えば防げると思います。
余談ですが、クエン酸は現在デンプンや糖を発酵させることで工業的に生産していますが、この方法が実用化される前は今回の実験のように果実から直接抽出していたそうです。
【おまけ】
レモン果汁にはクエン酸以外にも様々な有機物質が含まれています。今回はそのうちのブドウ糖とビタミンCが含まれているか調べてみたいと思います。方法は至極簡単でブドウ糖はおなじみベネジクト液で、ビタミンCはヨウ素液(うがい薬)で検出します。
ブドウ糖(グルコース)はベネジクト液で検出します。
ビタミンCは強い還元作用を有し、それにより三ヨウ化物イオンを還元するため、色が消えます。
ビタミンCはL-アスコルビン酸が正式な名前で、下の左の構造をしています。(L-は異性体を区別する記号で、今回は扱わないので以後省略します。いつか解説します。)

青で囲った部分はエンジオール構造(エンは二重結合、ジオールは二つのヒドロキシ基を表します。)とよばれ、強い還元性を示します。ここにヨウ素が攻撃しヨウ素は還元され無色のヨウ化水素になります。するとアスコルビン酸は酸化され左のデヒドロアスコルビン酸になります。すると赤で囲った部分のようなジケトン構造になります。なおヨウ素単体は本来水には溶けませんが、I⁻存在下ではI₃⁻(三ヨウ化物イオン)となり溶解しています。
本筋と逸れますがせっかく分子構造を見ていただいたので、なぜアスコルビン酸がクエン酸のようなカルボキシ基をもたないのに「酸」と呼ばれるのか、この理由を説明したいと思います。
下の図はアスコルビン酸の共役塩基であるモノデヒドロアスコルビン酸イオンの共鳴式です。

先ほどのエンジオール構造の隣にカルボニル基(=O)が存在するとレダクトン構造とよばれこれは上のような機構で共鳴安定化したエノラートアニオンになります。そのため3位の炭素に付いてるヒドロキシ基の水素の酸性度が高くなりプロトンを放出しやすくなります。実際アスコルビン酸のpKaは4.17で、酢酸は4.8なので酢酸よりも強い酸の性質を示します。すなわちこのエノラートはカルボキシラート並の共鳴安定化を受けていることになります。(ちなみに同じ理由でケト-エノール平衡もエノール形に偏ります。)
ビタミンCについて理解を深めていただけたところで実験に入りたいと思います。
①試験管にレモン果汁数滴と中和するための炭酸ナトリウムとベネジクト液2,3滴を加え加熱します。
②別の試験管にレモン果汁数滴とうがい薬2,3滴加えます。果汁の色が強くわかりにくい場合は希釈するなり、デンプンを加えてみてください。
ベネジクト液を加えた方は左のように赤褐色の沈殿を生じ、うがい薬とデンプンを加えても右のように淡黄色のままでした。

このことからレモン果汁にはブドウ糖とビタミンCが含まれていることが分かりました。
以上で全ての実験は終了です。久々にがっつり実験できて楽しかったです。読んでくださりありがとうございました。
ps.レモンの皮はいろいろしておいしく食べました。

≪≪ 戻る
