みなさんこんにちは、応化くまくです。
今回は前回合成した酢酸カルシウムからアセトンを得ようと思います。(まだ前編を見てない方は先に前編を見てください!)
※先に言っておきますがこの実験、結果が非常に微妙です。はっきり言って失敗してます。でも頑張ったので見てください<(_ _)>。
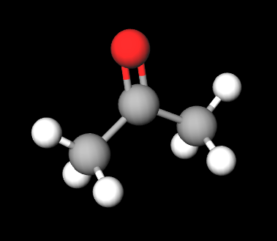 アセトンは比較的耳なじみのある物質なのではないでしょうか。最も有名な用途は除光液だと思いますが、その他にも有機溶媒や実験器具の洗浄にも用いられています。アセトンは下の写真のようなケトン基に2つのメチル基が付いた構造をしており別名ジメチルケトン(Dimethyl ketone)ともいわれます。(灰がC、赤がO、白がH)
アセトンは比較的耳なじみのある物質なのではないでしょうか。最も有名な用途は除光液だと思いますが、その他にも有機溶媒や実験器具の洗浄にも用いられています。アセトンは下の写真のようなケトン基に2つのメチル基が付いた構造をしており別名ジメチルケトン(Dimethyl ketone)ともいわれます。(灰がC、赤がO、白がH)アセトンの物性情報について
化学式:(CH₃)₂CO 分子量:58.08 沸点:56.2℃ 凝固点:-94.7℃ 引火点:-20℃ 比重:0.8 蒸気比重:2.0
無色透明の液体 消防法の定める危険物第4類引火性液体の第一石油類(引火点が20℃未満)に分類されます。
そんなアセトンを合成する訳ですが、今回の方法の原理は意外とシンプルで、酢酸カルシウムを加熱するだけです。ですが空気中でただ加熱しても生成したアセトンを回収することはできません。よって「乾留」という方法でアセトンを発生させ回収します。乾留とは空気を断った状態で固体有機物を熱分解し揮発性物質と不揮発性物質に分離させる手法のことです。
アセトンは2-プロパノールの酸化や工業的製法としてクメン法の副産物としても得られます。
酢酸カルシウムを約160℃以上で熱すると熱分解が起こり、炭酸カルシウムとアセトンに分解します。
反応式:Ca(CH₃COO)₂→CaCO₃+(CH₃)₂CO
その反応機構は以下のようなものが考えられています。酸素のローンペアが倒れ、二重結合の電子がカルボニルの根元に求核攻撃していき、、、という感じです。(*で示した平衡はケト-エノール平衡とよばれます。)

参考文献:https://chemtymology.co.uk/2018/09/28/acetone/
このようにカルボキシ基から二酸化炭素(炭酸)が抜け落ちる反応を脱炭酸反応といい、高校化学ではこの実験の他にも酢酸ナトリウムに強塩基を加えメタンを発生させる反応もこれに該当します。
◆使用器具◆
・試験管
・チューブ付きゴム栓
・ビーカー
・スタンド
・アルコールランプ
◆使用試薬◆
・酢酸カルシウム一水和物
・氷水
◆操作◆(火を使うのでやけどに注意しましょう。)
① 氷水を入れたビーカーに空の試験管を浸します。(中に水が入らないように。)
② 酢酸カルシウム一水和物3.25gを試験管にとり、チューブ付きゴム栓を付けます。チューブの反対側は①の試験管に挿し込みます。

③ スタンドで固定しアルコールランプで加熱します。(固体試料の加熱は必ず試験管の口を下げること。)

④ 酢酸カルシウム全体が黒くなったら加熱を止め、アセトンが集まった試験管を取り出します。(この時点では水などの不純物が混じっています。)
のはずだったんですが何回やってもここの④の操作でアセトンが集まらず、実験は失敗になりました。この実験はとある海外の実験系youtuberの動画を参考にしていたのですが、その人の収率が37%と低く、難易度の高い実験だと思われます。詳しい考察は後述。ひとまずここが上手くいっていた想定で操作を書きます。

⑤ アセトン入りの試験管にチューブ付きゴム栓を付け、56~60℃の間で湯浴し蒸留します。(アセトンは水との共沸点をもたないので上手くやればかなりの高純度のアセトンが得られるはずです。)
⑥ 蒸留が完了したら湯浴を止め、アセトンを回収します。
⑦ 得られたアセトン数滴を発泡スチロールにかけ溶けるのを確認します。(試薬に余裕がある人はヨードホルム反応などにより生成を確認してもいいです。)
⑧ 秤量し収率を決定します。
以上でアセトン合成の操作は完了です。
さて、今回の失敗の原因ですが、反応スケールが小さかったことや、酢酸カルシウム一水和物の純度が低かったことが挙げられます。反応スケールが小さいためアセトンが生成し溜まっていく速度よりも揮発していく速度の方が速かったのだと考えられます。またこの実験で印象に残ったのは加熱後の悪臭と加熱していた試験管に溜まっていた淡褐色の液体です。

これらは酢酸カルシウム一水和物中に含まれていた有機不純物由来のものだと考えられます。
ちなみに試験管に残っていた反応後の黒い固体に10%の塩酸をかけると気体の発生が確認できました。

これは以下の反応により二酸化炭素が発生していたと考えられます。
CaCO₃+2HCl→CaCl₂+CO₂↑+H₂O
したがって、熱分解は正常に進んでいたと推測されます。
またこの酢酸カルシウムの乾留はアセトンの製法として数研出版の化学図録三訂版p180にも紹介されているほどポピュラーなものです。
【引用:数研出版 化学図録三訂版 p180 著者:星野泰也】

しかし今回の結果を踏まえ、本当にこの写真の量でアセトンが捕集出来たのかと疑問に思い出版社に問い合わせようとしたのですが、発行物の内容に関する質問にはお答えいただけないようですのでここで諦めました。
ここから悪あがきです。なんとかしてアセトンが生成していることを同定はできないまでも確認をしたく、薬さじに酢酸カルシウム一水和物を少量とりアルコールランプで加熱しました。すると酢酸カルシウムが膨らみ火から離しても燃え続けました。アセトンが生成し燃焼しているのでしょう。

少々不格好でしたが実験に失敗はつきものです。失敗は成功の準備運動ともいいますしこの実験をするにあたって多くのことを学べたので良かったです。それではこれにて卵の殻とお酢からアセトンと燃えるジェルを作る実験は完了としたいと思います。最後まで読んでくださりありがとうございました!
PS.ゴム栓のとこに溜まっていた液体がアセトンの水溶液の可能性があるので試薬がそろえばヨードホルム反応を行い追試します。
≪≪ 戻る
