みなさんこんにちは。お久しぶりです。
1年ぶりの実験記事更新となりした。大学受験や大学生活や私生活で色々と忙しかったり、別の長期的なガッツリ研究に割いたりなどして更新を疎かにしていました。この度私は某薬学部の4年制学科(生命創薬科学科)に進学しました。薬学部と聞くと誤解されやすいのですが薬剤師になる6年制ではなく創薬研究者になる4年制です。メドケムってやつですね。4年制には国家試験の受験資格がありません。なので最初から薬剤師にはなることができません(システム的には転科はあるが別に眼中に無い)。
さて、近況報告はこの程度にして今回の実験は化合物合成です。しかもこのブログらしく猛毒のね。あ、ここだけの話しますと最初このブログサイトを創設した初期メンは家で出来る科学実験や化学の座学解説などをまとめた総合理系サイトを目指してたっぽいんですけど僕だけ解釈違いで好き勝手色んな実験して、しかもまあそれが薬毒劇物ばかり(だって薬毒物オタクだもん)だったもんでBANには至らないものの通報が相次ぎ有害サイト指定を食いフィルタリングかなんかで検索に載らなくなりました。なのでこれを見れるのはURLから飛ぶしかないわけです。僕たちは別に化学的事実を公にしただけであってこれを使えばテロを起こせるぜグヘヘなんてアングラなダークウェブにした覚えないんですけどねぇ…このサイトの所長の私から一言、通報した奴ら全員一生金輪際化学に触れずにくたばってください。
●今回の実験と合成物について
コイツの存在自体はかなり昔小学生の時くらいに本で読んで知り、おうちラボ始めていつか合成したいなぁなんて思っていたんですがどうにも良い合成方法が思いつかない…
ちなみに今回作るのは「パリスグリーン」というエメラルドグリーンの綺麗な顔料でヒ素を含みます。ゆえに超猛毒。パリスグリーン作りたいなぁと思って海外の試薬販売サイトでヒ素の単体をポチってみたもののさてこれを一体どうすればパリスグリーンになるのか。そもそもパリスグリーンというのはアセト亜ヒ酸銅という物質で化学式はCu(COOH)₂・3Cu(AsO₂)₂てな感じです。結構見た目キモいですが、酢酸銅と亜ヒ酸銅の複塩であることがわかります。

複塩とはイオン化合物(塩)のうち陰イオンもしくは陽イオンが2種類存在するもののことを言います。代表例としてミョウバンなんかは硫酸アルミニウムカリウムとアルミニウム、カリウムの2種類の陽イオンが1つの塩に収まってます。あとはロッシェル塩でお馴染みの酒石酸ナトリウムカリウム。なので合成自体は酢酸銅と亜ヒ酸を混ぜて反応させると沈澱してくるのでそれを回収するだけという具合なのですがこの「亜ヒ酸」がなんとも…亜ヒ酸は水に溶けて水和した三酸化二ヒ素のことです。古くは毒性を利用して農薬や殺鼠剤あるいは検出技術が無かった時代の完全犯罪的毒殺に使われたことも。そんな三酸化二ヒ素ですがヒ素の酸化物なので案外簡単に作れそうじゃんと思ったら大間違い。肝の据わってる人なら作れるかもしれませんが相当怖いことします。焙焼です。古くは江戸時代には硫砒鉄鉱を焼いて「石見銀山ねずみ捕り」という殺鼠剤を作るのに三酸化二ヒ素を製造していてこれを「亜砒焼き」と呼んでいました。または石黄(雄黄)、オーピメントという黄色の顔料としても使われるヒ素の鉱物がありますが正体は三硫化二ヒ素。これを空気中で炙ることで三酸化二ヒ素が得られます。このとき二酸化硫黄が出ます。
2As₄S₃+9O₂→2As₂O₃+6SO₂
さて三酸化二ヒ素の製造法を紹介しましたが、みなさんこれやりたいですか?私は絶対やりたくないです。何しろ三酸化二ヒ素には昇華性があるのですから、これらの空気中の酸素による焙焼で酸化物を得る方法でもれなく超猛毒ヒ素スモッグが発生してあなたを天へと導くでしょう。まあ実際に石黄の焙焼で三酸化二ヒ素を見事合成した海外のおうちラボ勢、通称ガレージケミストYouTuberが成功させているので気になる人は「Making Arsenic Trioxide」とでも検索してみてください。
と、このように三酸化二ヒ素の合成のハードルがクソ高い(というか怖すぎる)ことを知らずに適当に合成できるやろ、ヒ素化合物他に売ってないしという理由で買ったヒ素の単体からなんとかして作りたいわけです。しかも温和な条件でね。焙焼なんてあり得ないですよ、普通はビーカーやフラスコの中で溶液として試薬たちを反応させて濃縮して目的物を得ます。今回もそれに則ります。死にたくないので。
●合成法について
元素の単体から欲しい化合物を合成するときのまず最初のステップは単体を酸化することです。すなわちイオンなど水に溶ける形にすることです。それに必要なのが濃硝酸。圧倒的酸化力でほとんどの金属はこいつで溶かせます。塩酸と混ぜれば王水になってプラチナも金も溶かせます。まあ硝酸使わなくても適当な酸と過酸化水素水を混ぜたものでも金属溶かせるんですけどね(ex.酢酸+過酸化水素水で酢酸鉛を合成)。なのでセオリー通りヒ素を硝酸に溶かします。それ以外にこいつを化合物にする手段が無い。反応式はこんな感じ。
As+5HNO₃→H₃AsO₄+5NO₂+H₂O
ここで出来るのがH₃AsO₄、ヒ酸です。
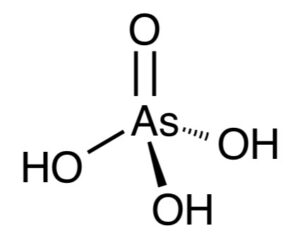
ヒ素のオキソ酸なんですがこいつは目的物ではありません。欲しい三酸化二ヒ素(亜ヒ酸)のヒ素の酸化数は+3、一方ヒ酸は+5です。つまり濃硝酸で酸化されすぎたわけです。酸化数を2減らすには酸素を1個減らせば良いですね。なので還元します。ちなみにヒ酸と亜ヒ酸、名前が似てますがこの「亜」は基準となるオキソ酸と比べて酸素が1つ少ないときに名前につきます。さらに酸素が減ると「次亜」になります。逆に酸素が1つ増えると「過」が付きます。この命名法は塩素酸やリン酸、硫酸などに見られますね。さて話を戻してヒ酸を還元したいわけですがなんと幸いヒ酸には酸化力があるのです。というのも同周期元素のオキソ酸であるセレン酸や臭素酸は強い酸化力を持ちます。なのでヒ酸も彼らほどではないですがそれなりの酸化力を持っていてヨウ化物イオンをヨウ素にすることができます。
(H₃AsO₄+2H⁺+2e⁻→H₃AsO₃+H₂O)
(2I⁻→I₂+2e⁻)
H₃AsO₄+2H⁺+2I⁻→I₂+H₃AsO₃+H₂O
でヒ酸が酸化還元反応を起こした後に生成するH₃AsO₃こそが僕が求めていた亜ヒ酸(三酸化二ヒ素の水溶液)です!
フラスコの中で作れるじゃん!お前!ということで相手の還元剤選びですがパッと思いつくのがシュウ酸とホルムアルデヒドでしょう。シュウ酸は酸化されれば二酸化炭素になってどっか飛んで消えて溶液内に残りませんし、それなりに強い酸なので酸化還元反応のプロトン源にもなれますしね。反応式はこうなると予想されます。
H₃AsO₄+2H⁺+2e⁻→H₃AsO₃+H₂O
H₂C₂O₄→2CO₂+2H⁺+2e⁻
H₃AsO₄+H₂C₂O₄→H₃AsO₃+H₂O+CO₂
ホルムアルデヒドを使った場合も同様にヒ酸から酸化を受けてギ酸になり、ギ酸はさらに酸化されるので二酸化炭素と水になります。反応式はこう予想されます。
(HCHO+H₂O→HCOOH+2H⁺+2e⁻)
(HCOOH→CO₂+2H⁺+2e⁻)
(HCHO+H₂O→CO₂+4H⁺+4e⁻)
(H₃AsO₄+2H⁺+2e⁻→H₃AsO₃+H₂O)
2H₃AsO₄+HCHO+H₂O→2H₃AsO₃+H₂O+CO₂
シュウ酸かホルムアルデヒドかどちらが使い勝手が良くて還元性に優れているかといえばホルムアルデヒドでしょう。完全にヒ酸を還元するにはmol計算より少し過剰量の還元剤を入れる必要があります。未反応の還元剤の場合シュウ酸は残りますがホルムアルデヒドやギ酸は溶液を煮沸すれば揮発してくれるのでより純粋な亜ヒ酸水溶液が得られるわけです。単体ヒ素を細かく砕き、湯浴で温めながら濃硝酸に溶かしてヒ酸としたのちホルマリンを加えます。反応形内の物質がヒ酸と硝酸でどちらも酸化剤なので反応が完全に進行したかどうかはヨウ化カリウム水溶液に少量の反応液を滴下して色を見ます。もしヒ酸もしくは硝酸が残ってた場合はヨウ化物イオンが酸化されてヨウ素となり、周囲のヨウ化物イオンと合わさって三ヨウ化物イオンの黄褐色が観察されるはずです。逆に全て反応しきっていればヨウ化カリウム水溶液は無色のままというわけで、この手法で反応をモニタリングします。
2I⁻→I₂+2e⁻
I⁻+I₂→I₃⁻(黄褐色)
これにて亜ヒ酸の合成としたいと思います。
と、思った矢先、この記事を書くための予備実験にてシュウ酸やホルムアルデヒドでは還元が困難であることが判明しました。というのもプロトコルに沿って得られたものは色からして青色?青緑色のヒ酸銅(Ⅱ)でした。ということで最終兵器のヒドラジンを使いたいと思います。水酸化カリウム塩基性条件下でカルボニル基の酸素を飛ばしてメチレン基に還元できるウォルフキッシュナー還元に使われるあいつです。非常に還元力が強いので流石のヒ酸もノックアウトされることでしょう。という事情から今回は還元剤をシュウ酸やホルムアルデヒドではなく水酸化カリウム&ヒドラジン塩酸塩を使うことにします。医薬用外毒物には医薬用外毒物をぶつけるんですよ!
亜ヒ酸、三酸化二ヒ素の合成法は論文の反応上限を網羅的に検索できるwebサービスのSci-Finderでもヒットせず、すでに試薬として製品化されてるものを使った実験研究ばかりで唯一見つかる方法が上記の常軌の逸した恐れ知らずの方法です。なのでもしこの実験が成功すればこのブログ記事をもってして論文級の、亜ヒ酸、三酸化二ヒ素の合成法の新情報となるわけです。
さて、三酸化二ヒ素のお相手の酢酸銅ですがなんと持っていない…塩化銅、硫酸銅、硝酸銅は持ってるのに酢酸銅だけ持ってないのです。まあ仕方がないので酸化銅(Ⅱ)と酢酸から作りましょう。これは混ぜて加熱するだけで水溶液が得られるので大した仕事じゃありません。
CuO+2CH₃COOH→Cu(CH₃COO)₂+2H₂O
酢酸ナトリウムに計算量の塩酸を加えたのち酸化銅を加えて加熱しても同じように酢酸銅が得られます。弱酸遊離反応で酢酸が生じるので。塩化ナトリウムは反応に影響しないので無視して構いません。
CH₃COONa+HCl→CH₃COOH+NaCl
CuO+2CH₃COOH→Cu(CH₃COO)₂+2H₂O
酢酸銅水溶液に得られた亜ヒ酸を加えて加熱還流すれば緑色のパリスグリーンが沈殿してくるはずです。反応を総括すると
4CuO+3As₂O₃+2CH₃COOH→Cu(CH₃COO)₂•3Cu(AsO₂)₂+H₂O
●パリスグリーンについて
パリスグリーンの歴史は18世紀に遡ります。1775年にスウェーデンの化学者によってシェーレグリーンという製法によって黄緑色?深緑色を示す亜ヒ酸顔料が合成されました。硫酸銅水溶液に三酸化二ヒ素を溶かして炭酸カリウムを加えてアルカリに傾けると沈澱してくる塩基性亜ヒ酸銅です。当時の緑色顔料と言えば塩基性炭酸銅のマラカイト(孔雀石)でしたからこの色褪せない新しい緑色は画期的だと、製造法を秘密にされたこともあってこぞって各地で再現を試みる研究が行われました。その中で生まれたのがアセト亜ヒ酸銅、パリスグリーンです。パリスグリーンは美しいエメラルドグリーンを示し瞬く間に世界中へ広がり工業的生産が行われました。主にヨーロッパのビクトリア朝の新鮮な植物の葉をモチーフにするのに壁紙やありとあらゆる場所に使われていました。が、このとき突然謎の奇病ゴシオ病が流行り始めたのです。この奇病の犯人は「カビ」でした。壁紙に繁殖したカビはパリスグリーンを取り込み生化学的プロセスを経て有機ヒ素化合物を大気中に放ちました。人々はこれによって慢性的ヒ素中毒を引き起こしたのです。フランス革命に干渉する諸国との戦争を勝ち破りヨーロッパの大半を勢力に置き軍事独裁政権を確立したかの有名な革命家ナポレオンも遺体の毛髪検査からこのパリスグリーンによるヒ素中毒を起こしたとされています(諸説あるが当時美白化粧水として使われていたヒ素化合物の水溶液トファナ水を使ったという説も)。
日本ではパリスグリーンを花緑青と呼びました。10円玉などの青銅製品に湿気で生じる青緑の錆、緑青はみなさん見たことあると思います。使い込まれて汚れた10円玉然り、鎌倉の大仏やニューヨークの自由の女神なんかは長い間雨風に晒されて緑青に覆われています。そしてこの緑青は毒だと子供の頃に言い聞かされませんでしたか?確かに緑青の主成分は塩基性炭酸銅で銅塩である以上重金属的毒性を持ちますが大量にガブガブ食べない限り人体に対して重篤な症状を引き起こすほどそこまで毒性は強くありません。この緑青は猛毒だというのは恐らく本当に猛毒だった花緑青との混同から来たものでしょう。
●ヒ素について
ヒ素は原子番号33番、元素記号As、15族のプニクトゲンに属する典型非金属元素で黒い金属光沢を持ち、空気に晒されると速やかに表面が鈍くなり黒くなります。


ヒ素とガリウムとの固溶体であるヒ化ガリウムは半導体に使われたりします。
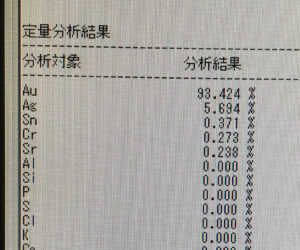
さて、ヒ素は自然界にどのような形で存在するのか、鉱物マニアの間では結構有名なのが福井県赤谷鉱山の自然砒。元素名の前に「自然」が付くのはその鉱物が自然に産出された元素の単体、元素鉱物であることを表します。例としては自然金や自然銀、自然白金、自然銅、自然硫黄、珍しいものだと自然蒼鉛(蒼鉛はビスマス)、自然アンチモン、自然テルルなど。意外と元素鉱物は多いんです。ただし単体だからといって完全に純粋というわけはなく天然に産出するくらいですから多少の不純物を含みます。試しに僕の持ってる自然金を蛍光X線元素分析してみたところ93%Au、残りがAg、Sn、Crでした。純金が24Kだとすると大体22K相当の金塊です。


話を戻してこの赤谷鉱山で採れる自然砒は世界的に見ても珍しく博物館に展示されるほどです。なぜならその形は結晶が放射状になりトゲのある球体になっているからです。大きさ1~1.5cmほどでコロコロとしたその見た目から「金平糖石」なんて呼ばれたりします。猛毒鉱物に美味しそうな名前を付けるとは。なかなか出回らない希少価値の高いレアな鉱物標本です。

ヒ素は黒光した銀色の金属光沢を持ちますが自然砒では通常酸化されて黒ずんだ塊状で産出することがほとんどです。さらに風化が進むと方砒華という天然の三酸化二ヒ素が表面に吹いてきます。これは現在2022年11月~2023年2月まで行われている特別展「毒」のグッズ販売コーナーで購入した自然砒。後日改めて2回目のチケットで入場してグッズコーナーを確認してみたら自然砒だけでなく石黄や鶏冠石(どちらもヒ素の硫化物)、辰砂(硫化水銀)、硫砒鉄鉱など有毒元素を含む鉱物標本が売られていたコーナーが一掃されて別のグッズ置き場になっていました。一体何があったんでしょうか。闇が深いです(ちなみに単体のヒ素は毒劇物取締法による毒物に指定されているが鉱物は化学薬品と見做されないので販売が可能。だとしても…)。貴重な最後の1個の標本だったのかもしれません。買わずに後悔してたまるかと買ってよかったです…。

自然砒以外にもヒ素は自然界に存在します。
・硫砒鉄鉱(FeAsS)

・紅砒ニッケル鉱(NiAs)

・コバルト華(Co₃(AsO₄)₂)

・雄黄/石黄(As₄S₃)

さて、ヒ素は猛毒というイメージは全人類共通認識だと思いますが実は有機ヒ素化合物はかなりの量が海藻のひじきに含まれていたり、我々の人体に欠かせない必須微量元素にヒ素があったり、有機ヒ素芳香族化合物のサルバルサンは
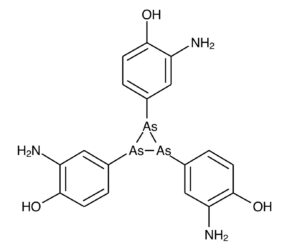
抗生物質ペニシリンが普及する以前の梅毒の特効薬だったり上記で言及した三酸化二ヒ素は白血病や抗がん剤などの治療薬に使われているなど毒と薬は紙一重、毒と薬は量、というわけです。
ヒ素といえば和歌山毒物カレー事件が有名です。夏祭りの屋台のカレーに毒物が混入されていた事件で多数の犠牲者を出した忌まわしい事件です。その凶器は当初青酸化合物(シアン化合物)かと思われていましたが再分析の結果亜ヒ酸と特定されました。犯人は死刑を宣告されました。何故このようにしてヒ素は人体に対して強力な毒性をもたらすのか。その原因は至ってシンプルで、人体を構成する最重要元素の一つリンとファンデルワールス半径すなわち原子の大きさが似てるからです。リンは生体代謝に関係する元素でヒ素はそれに似てるためリンもどきとして入り込みます。当然リンではない偽物ですから代謝反応を起こすことができずに中毒を起こし多臓器不全を引き起こして死に至らしめます。この原子の大きさが似てることで毒性を発揮するという作用機序はタリウムとカリウムにも見られます。タリウムもかつて殺鼠剤に用いられた猛毒で劇物の酢酸タリウムを手に入れた化学知識に長けた女子高生が友人や母親に投与しその様子を観察日記に残すというタリウム少女事件も知ってる人は知ってると思います。現在はヒ素の単体およびその無機化合物全てが毒物及び劇物取締法によって毒物に指定されています。もちろんパリスグリーンも。パリスグリーンはラットの経口での半数致死量が22mg/kgという筋金入りの猛毒です。パリスグリーンという名前自体は今でも顔料として残っており使われていますが中身の成分は全くの別物でアセト亜ヒ酸銅のエメラルドグリーンを再現した安全性の高いものとなっています。
●実験
※注意
ヒ素およびその化合物、ヒドラジンは非常に強い毒性を有します。濃硝酸、水酸化カリウムは皮膚粘膜腐食性を有します。いずれの試薬も薬傷、失明の危険性があり、重篤な事故につながる恐れがあります。安易な真似は控えてください。実験者は白衣、保護眼鏡、手袋を着用し、必要に応じて局所排気設備を使用しています。
◆材料◆
・金属ヒ素
・濃硝酸
・ヒドラジン二塩酸塩
・水酸化カリウム
・酸化銅(Ⅱ)
・酢酸
◆器具・装◆置
・三角フラスコ
・1000mL丸底フラスコ
・ビーカー
・乳鉢
・湯浴
・ジムロート冷却器
・冷却水循環装置
・ホットマグネチックスターラー
・マントルヒーター
① ヒ素17.20を乳鉢で細かく砕く。


② 砕いたヒ素を三角フラスコに移して濃硝酸88mLを加えて撹拌する。溶けが悪い場合は湯浴で穏やかに加熱する。二酸化窒素が発生するので局所排気設備を用いること。溶液を沸騰させて硝酸や二酸化窒素を追い出す。ヒ酸水溶液が得られた。


③ ヒ酸水溶液の過剰な硝酸を炭酸カリウムで中和し、水酸化カリウム60gとヒドラジン塩酸塩60gを加えて4時間湯浴で70~80℃ほど加熱撹拌する。


④ 溶液が白く濁ってヨウ化カリウム水溶液呈色テストが陰性になったら塩酸で液性を中性にして三酸化二ヒ素を析出させる。吸引ろ過して回収する。



⑤ 酸化銅(Ⅱ)16gを三角フラスコに入れる。

⑥ 水150mLと酢酸40mLを加えてジムロート冷却器を取り付けて2時間加熱還流する。


⑦ 還流後、溶液が冷めたら吸引ろ過で未反応の酸化銅(Ⅱ)を取り除く。

⑧ ろ液の酢酸銅水溶液を1000mL丸底フラスコに移して三酸化二ヒ素を加えてマントルヒーターで加熱還流する。


⑨ 溶液が水色から緑色に変化したら加熱をやめ、室温放冷する。冷めたら吸引ろ過で緑色の沈殿固形物を回収する。メタノールで濯いで水分を落とす。ろ液はヒ素を含む可能性が高いので別途容器に封印する。
ロートから取り外して時計皿に乗せて水蒸気浴で乾燥させる。パリスグリーンが得られた。






めでたくパリスグリーンを合成することができました。あまりの毒性の高さゆえ葬り去られた幻の顔料です。この合成物は法令上毒物に相当するので絵の具としての使用は論外、密閉封印して厳重に保管しましょう。
それでは次回の実験までさよなラジカル
えざお
≪≪ 戻る
