みなさんこんにちは。
突然ですがランタノイドという言葉を聞いたことがあるでしょうか。元素好きの方からしたら愚問ですね。ランタノイドは元素周期表の第3族、第6周期にある15個の元素群を指します。突然1マスに15個も収められないので現在の周期表は下に別枠が用意してあります。15×2の長方形の部分です。ランタノイドの下はアクチノイドと呼ばれています。
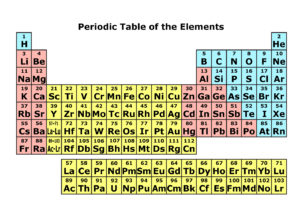
古い元素周期表であるためニホニウム(Nh)?オガネソン(Og)が抜けている。
さらに第3周期のスカンジウム(Sc)とイットリウム(Y)を併せて希土類、またはレアアースと呼ばれます。希土類は我々の生活には無くてはならない存在です。身近な利用例では百円ライターの火打ち石(La,Ce)、蛍光灯(Eu)、蓄光素材(Dy)、永久磁石(Nd,Sm)、時計針の蛍光塗料(Pm)、MRI血管造影剤(Gd)、光ファイバ(Er,Tm)、光磁気ディスク(Tb)、レーザー(Y)、超伝導体(Y,Nd)などがあり、エレクトロニクス製品や光学素材に欠かせない存在です。
●希土類について
希土類、レアアースと聞くとかなり希少な資源のように思えますが実はそういうわけでもなく、セリウムに関しては銅と同等の地殻埋蔵量と言われています。もちろん本当に希少なものもあります。ルテチウムなんかは一時期金よりも高価でした。それにしても希土類は今現在でもほとんど高値で流通しています。それは希土類同士の性質が似すぎて分離するのにコストがかかるためです。どれくらい分離するのが困難かというと希土類元素の発見時、複数の単体からなる混合物が単一の元素だと思われていたくらいです。それがジジミウムです。ジジミウムはプラセオジムとネオジムの混合物だったのです。そうしてあれやこれやと研究を進めてランタノイドが満を辞してずらっと揃うのに100年近くかかりました。また、性質が似るということは自然界で共存しやすいということでもあり、同一の鉱物中に複数のランタノイドが存在してることがザラにあります。なんだか白金族元素と似ていますね。希土類を含む代表的な鉱物にはモナズ石、ガドリン石、バストネス石が知られています。
 |
 |
 |
| モナズ石 | ガドリン石 | バストネス石 |
さて、何故これほどまでに希土類は性質が似てしまうのか、それはもちろん原子の構造にあります。ここで一旦希土類から離れて原子構造の話に移ります。高校の化学ではK殻に2個、L殻に8個、M殻は18個収容できるけど実際は8個埋まったら次の電子殻、という風に習ったと思います。なぜ収容数を満たさずして次の電子殻に電子が入れるのか不思議ではないですか?それは構造原理にあります。そもそも電子軌道にはs軌道、p軌道、d軌道、f軌道という種類があります。そしてK殻には1s軌道が、L殻には2s軌道と2p軌道が、M殻には3s軌道と3p軌道と3d軌道が、N殻には4s軌道と4p軌道と4d軌道と4f軌道が、...あります。数字はただの割り振られた番号だと思ってください。
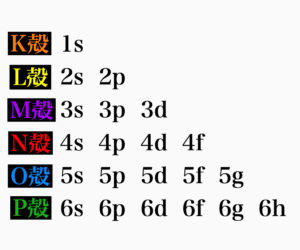
そしてこれらの軌道をエネルギーが低い順に並べると1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→4f→5d...となります。そして電子たちはエネルギーの低い軌道から埋まっていきます。電子が埋まる収容数はs軌道が2個、p軌道が6個、d軌道が10個、f軌道が14個です。
ここでユウロピウム(Eu)を例にして電子を埋めてみると図のようになります。

()の中身は電子の個数を表しており、ユウロピウムの原子番号は63番ですからきっちり電子数の合計になってることがわかります。そしてこの電子の配置を観察してみましょう。s,p,d軌道にはすべて電子が埋まり、4f軌道だけ7個と定員14個を満たしていない、すなわち不対電子がある状態となっています。しかし原子の性質を決めるのは最外殻電子です。ランタノイド元素は全て6s軌道を埋めているため最外殻電子数が同じであるうえに5s軌道と5p軌道も全て共通して埋めています。不対電子が内殻の4f軌道にあり、外殻電子数が同じであること、これが希土類元素同士の性質が似てしまう原因なのです。ちなみに4f軌道と5d軌道のエネルギー差が小さいため稀に5d軌道に電子が入り込んでしまう場合もあります(La,Ce,Gd,Lu)。
●希土類の蛍光性
まず、不対電子は光や熱のエネルギーを受け取り別の軌道に移ることができます。これを励起といいます。励起状態(活発な状態)は長続きしませんからしばらくすれば元に戻ります。この元の状態を基底状態と呼び、励起→基底に遷移するとき、その差分のエネルギーを電磁波として放ちます。電磁波の波長が可視光領域にあるとき我々は色として認識することができます。この現象の代表的な例が炎色反応です。?E = hν(h:プランク定数,ν:光の振動数)という式の通り、光の波長は励起→基底のエネルギー差に依存します。
さて、先程は希土類には4f軌道に不対電子があると言いました。この電子が別軌道に移動して励起状態へと遷移するわけですが他の元素と違う点は5s軌道、5p軌道、6s軌道に囲まれているため励起状態が外的影響を受けにくいという点にあります。このため希土類が発するスペクトルピークは鋭く、鮮明な発光をすることができます。特に顕著なのがユウロピウムやテルビウムで、ユウロピウムから作られた蛍光体は赤色発光することが知られています。昔のブラウン管テレビは三原色の一つである赤色を作ることができず、他の色の明度彩度を調節して赤色の雰囲気を補っていました。しかし、ひとたびユウロピウム蛍光体が現れてからというものテレビのカラー化が始まり、もはや革命と言うべきエレクトリックな大躍進を遂げたのです。ちなみにカラーテレビの商標「キドカラー」のキドは希土類の希土と輝度をかけています。
以上で座学編としたいと思います。
希土類の話をするつもりが原子構造まで掘り下げるハメになるとは。ただでさえ重い内容なのに専門用語がたくさんで少々疲れてしまったと思いますが、これを中高化学レベルに噛み砕くと文量が3~4倍になって短編小説レベルになってしまうので勘弁してください。それでは次回の実験編までさよなラジカル。
えざお
〈実験編はこちら〉
≪≪ 戻る
