みなさんこんにちは。
今回は数少ない常温常圧で液体の元素、臭素を作っていきたいと思います。この実験を初めて見た時の感想としては「やりたくねぇ」の一言に尽きました。あまりにも怖すぎるからです。それから早4年、自宅にドラフトチャンバーを導入し、ある程度化学実験の経験値を貯めた今、「やってみたい」が「怖い」を超えてしまったのです。ただ怖いし危険であることには変わりないので慎重な操作と共に安全配慮には全力で取り組みます。


●臭素について
臭素は主に自然に存在する臭化物イオンを酸化することで得られ、最初は海水に塩素を通ずることで発見されました。それ以降は臭化物塩が豊富な死海周辺の井戸水や地下水が主な産地となりました。今現在生産されてる臭素の大半は地下水から得られています。鉱物の中にも臭素を含むものがあります。代表的なものは臭化銀鉱でしょうか。
名前のまま組成はAgBrの臭化銀です。臭化銀をはじめとするハロゲン化銀には感光しやすいという性質があり、日光を当てると銀が析出して黒く変色します。これを利用したのがブロマイド写真です。ブロマイドは臭化銀の英語名Silver Bromideに由来します。さて、高校化学の資料集などで赤褐色の濛々とした液体の臭素を見たことがある人も多いかもしれません。臭素は常温常圧下で辛うじて液体を保っているだけで放置すればどんどん蒸発していきます。気体状態では赤褐色のいかにも毒ガスという見た目をしており外見通り毒性は非常に高いです。凶暴なハロゲン一族のメンバーですからそれなりに強い酸化力を持ち、皮膚に付いたらもれなく爛れます。そして名は体を表すように臭素は非常に臭いです。臭いと言ってもハロゲン特有の刺激臭というやつでモロに嗅いだら鼻粘膜が終わります。
やや専門的な話をすると、臭素は有機化学の世界では大変有用で、優れた脱離基としてはたらくので専らハロゲン化アルキルには臭素化物が使われますし単体の臭素を使って臭素化(ブロモ化)することもあります。おうちラボ的な事情を話すと有機合成をやる上でブロモ化を押さえたらかなり強いです。よりマイルドなN-ブロモスクシンイミドという臭素化剤もあるにはあるんですが冷蔵保存必須だし価格も高めでなかなか手が出せません。単体の臭素も大概ですが。
●臭素の作り方
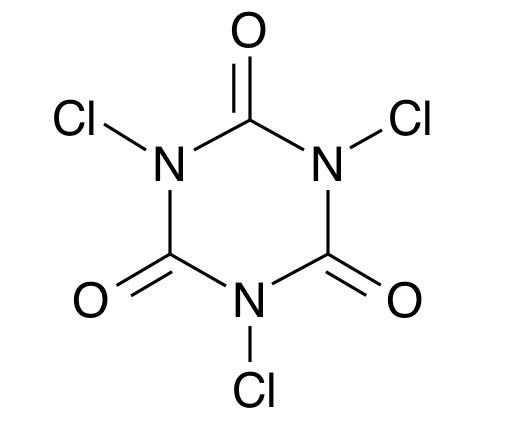
臭素を作る方法は工業的製法と何ら変わりません。臭化物イオンを酸化させます。ただ臭素は強力な酸化剤であるためこれを上回るさらに強い酸化力をもつ物質が必要になります。そう、塩素です。臭化物イオンを含む液に塩素をぶち込めば塩素より酸化力の弱い臭素が遊離します。高校化学では酸化力が強い順にF₂>Cl₂>Br₂>I₂となるハロゲンの酸化力序列を習うと思います。周期表の縦の並びそのままですね。塩素の発生方法ですが1番扱いやすいのがトリクロロイソシアヌル酸を使う方法です。
いきなり聞いたこともないような薬品が出てきましたがトリクロロイソシアヌル酸はプールの消毒に使われるような身近な塩素系殺菌剤です。これと塩酸を反応させると塩素が発生します。発生した塩素は臭化物イオンを酸化し、臭素が遊離するというプロセスです。
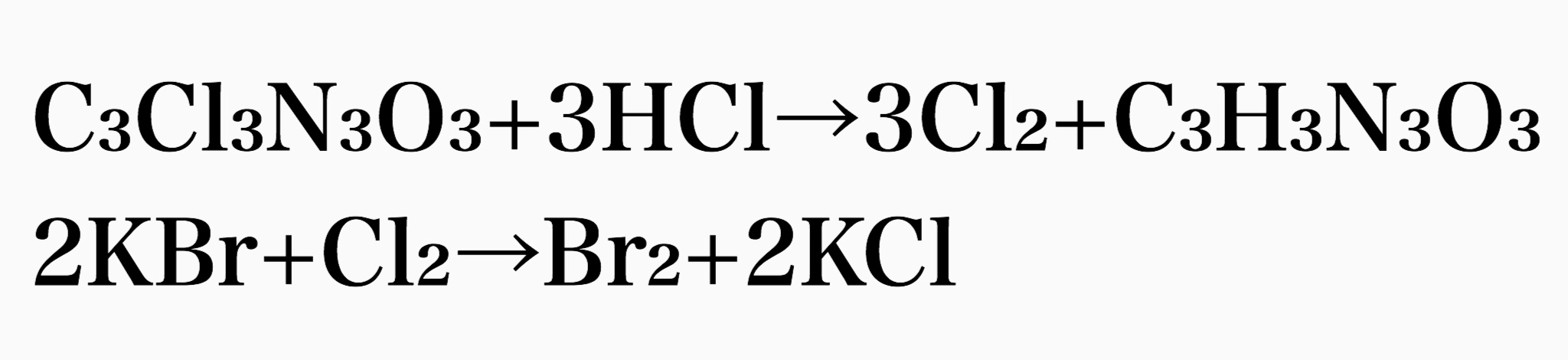
●実験
※注意
臭素は皮膚粘膜刺激性・腐食性を有する猛毒です。塩酸、濃硫酸は皮膚粘膜刺激性・腐食性を有します。いずれの試薬も薬傷、失明の危険性があり、重篤な事故につながる恐れがあります。安易な真似は控えてください。実験者は白衣、保護眼鏡、手袋を着用し、必要に応じて局所排気設備を使用しています。
◆材料◆
・臭化カリウム
・トリクロロイソシアヌル酸
・16%塩酸
・濃硫酸
◆器具・試薬◆
・1000ml二口フラスコ
・100ml丸底フラスコ
・側管付き滴下漏斗
・漏斗
・リービッヒ冷却器
・分液漏斗
・氷浴
・乳鉢
・ガラスアンプル
・ガストーチ
・スターラー付きマントルヒーター
・冷却水循環装置
・ドラフトチャンバー
① 臭化カリウム200gを水300mlに溶かす。


② トリクロロイソシアヌル酸錠を乳鉢で砕いて粉末状にしておく。

③ 二口フラスコに大きな回転子とトリクロロイソシアヌル酸72gと臭化カリウム水溶液を全量入れる。この時点でも既に臭素が生成する。

④ 反応装置を組み立てる。摺り合わせ部分には濃硫酸を塗って密着させる。留出液を回収するフラスコは氷浴で冷やしておき、アダプターにはチューブを取り付けチオ硫酸ナトリウム水溶液のトラップに誘導する。

⑤ 滴下漏斗に入れた16%塩酸60mlを滴下する。

⑥ 徐々に臭素が発生する。40~50℃に昇温して臭素の発生を促す。

⑦ 発生した臭素が凝縮して液体になりフラスコに溜まる。

⑧ 臭素の流出がある程度収まったら100℃に加熱して反応液を沸騰させ水蒸気ごと残った臭素を回収する。


⑨ 臭素は水に溶けにくく比重が大きいため二層に分かれる。慎重に分液漏斗に移して下層の臭素を回収する。水層は臭素水として利用するかチオ硫酸ナトリウムで処理して廃棄する。

⑩ 再度分液漏斗に臭素を移して濃硫酸20mlをゆっくり加える。慎重に振盪し、臭素を乾燥させる。濃硫酸は水に溶かしたのち中和し、チオ硫酸ナトリウムで処理する。

⑪ 下層の臭素を回収する。単体の臭素が得られた。収量は74.76gであった。

⑫ 試験管で作ったアンプルに封入する。アンプルはコニカルチューブに入れ、チオ硫酸ナトリウムを入れた瓶の中で保管する。実験に使う試薬として保存する場合は使い切りアンプルに封入する。


めでたく臭素を作ることに成功しました。本当にめでたい。無事でよかった。死ななくてよかった。安全管理は徹底したつもりなので無事なのが当たり前っちゃ当たり前なんですけれどね。臭素の生産を押さえてしまえばおうちラボでの有機合成は勝ち組です。ハロゲン一つ手に入れるだけで可能性が広がります。それにしてもこの厨二心をくすぐられる毒々しい見た目カッコいいですね。それでは次回の実験までさよなラジカル。
追記:
酸化剤にペルオキソ二硫酸アンモニウムを使うとさらに効率的な臭素の製造が行えることが判明しました。臭化カリウム水溶液(200g/500ml)にペルオキソ二硫酸アンモニウム水溶液(250g/400ml)を加えるだけです。臭素収量は123.91g。臭素以外の生成物が全て不揮発性なので先程の実験のように塩化水素などの揮発性成分がコンタミするリスクもありません。

えざお
≪≪ 戻る
