みなさんこんにちは。
今回はヨードホルムを合成していきたいと思います。ヨードホルム反応は高校化学の構造決定問題では定番中の定番でアセチル基ないしメチルカルビノール構造の存在を教えてくれます。
入試ではよく試料にヨウ素と水酸化ナトリウムを加えて加熱すると特異臭のする黄色沈殿が生じると記述されます。ちなみにアセチル基を持っていても酢酸のようなカルボニル基のα位が水素またはアルキル基ではない化合物はヨードホルム反応を示さないので要注意。「ヨードホルム反応が陽性の化合物をすべて選びなさい」なんて問題は出題者も楽に解答者の理解度を測ることができるので多用されがちです。対策しておきましょう。
●ハロホルム反応について
なぜヨードホルム反応でアセチル基が存在していることがわかるのか、反応機構を追ってみましょう。

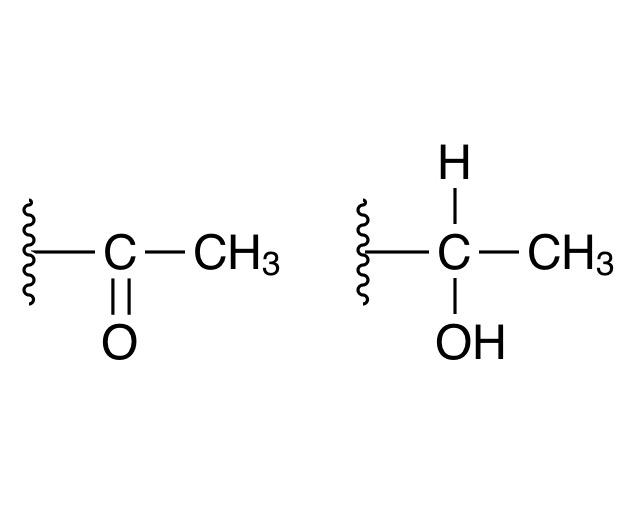
例としてアセトンにヨウ素と水酸化ナトリウムを加えた場合を考えてみましょう。まずアセトンのα位の水素を水酸化物イオンが引き抜きます。そのまま電子が酸素に流れて行きエノラートイオンが生じます。エノラートはすぐさまカルボニル基を再生させ、求電子的にα炭素がヨウ素化します。これをあと2回繰り返すとα炭素に3つヨウ素が置換した脱離能の高いハロメチルケトンができます。続いてカルボニル炭素に水酸化物イオンが求核付加し、カルボニル基再生とともに-CI?が脱離してカルボアニオンが生成します。カルボニアニオンは最終的に水素を受け取ってヨードホルムが生成します。この一連の反応はヨウ素だけでなく他のハロゲンでも起こるので一般的にハロホルム反応と呼ばれます。ヨウ素の代わりに塩素を使えばクロロホルムも作れるわけです。
●合成について
合成するならそれなりの量が欲しいところですがヨウ素の分子量が大きいせいで扱う量がえぐくなるので今回はより扱いやすいヨウ化カリウムと次亜塩素酸ナトリウムを使っていきます。次亜塩素酸ナトリウムは酸化剤なのでヨウ化カリウムからin situでヨウ素を発生させ即座にアセトンと反応させることができます。また次亜塩素酸ナトリウム自体塩基性なので水酸化ナトリウムは不要になります。
●実験
※注意
次亜塩素酸ナトリウムは皮膚粘膜刺激性・腐食性を有します。アセトン、エタノールは麻酔性と引火性を有します。いずれの試薬も薬傷、失明の危険性があり、重篤な事故につながる恐れがあります。安易な真似は控えてください。実験者は白衣、保護眼鏡、手袋を着用し、必要に応じて局所排気設備を使用しています。
◆材料◆
・ヨウ化カリウム
・6%次亜塩素酸ナトリウム水溶液
・アセトン
・エタノール
◆器具・装置◆
・適当容量ビーカー
・三角フラスコ
・吸引ろ過瓶
・マグネチックスターラー
・マントルヒーター
・水流式アスピレーター
① ヨウ化カリウム12gを水100mlに溶かす。


② 6%次亜塩素酸ナトリウム水溶液200mlを少しずつ加えていく。



③ 20分攪拌し続けると黄色沈殿が生じる。

④ 沈殿を吸引ろ過で回収する。

⑤ 適量の熱エタノールに溶かしたのち室温放冷して再結晶する。

⑥ ヨードホルムが得られた。

めでたくヨードホルムの結晶が得られました。教科書は「特異臭のする黄色沈殿」と表現していますが実際嗅いでみると歯医者さんのような匂いがします(伝われ)。一説によるとナチス指導者で有名なアドルフ・ヒトラーの母親は乳がん治療に使われたヨードホルムによる中毒で亡くなったらしいです。殺菌剤に使われるとはいえハロホルムは全般的に人体によろしくないので匂いがクセになるからと何回もかが無い方が良いです。それでは次回の実験までさよなラジカル。
えざお
≪≪ 戻る
