みなんこんにちは。
今回は高校化学の有機化学・天然物高分子にも登場する、セルロースの再生繊維キュプラを作ってみましょう。学校の実習実験でも扱われる有名なものです。では早速基礎知識を紹介していきます。
●多糖について
セルロースは多糖の一種で種類的に見ればデンプンと同じようなものです。しかし構造が違います。どう構造が違うのかというとデンプンはα-グルコースが螺旋状に連なっているのに対してセルロースはβ-グルコースが直線状に連なっています。なんだか訳がわかりませんね。もう少し噛み砕きます。
多糖というのは「多」が付くくらいですから単糖が連なっている高分子です。単糖は糖を構成する最小単位でグルコース(ブドウ糖)、フルクトース(果糖)、ガラクトース(脳糖)などがあります。デンプン、セルロースはこのうちグルコースが連なったものです。
ややこしいことにグルコースには2つの種類が存在するんですね。α-グルコースとβ-グルコースです。構造を見てみると一番右のOH基が下にあるか上にあるかでα,βと名前が変わります。
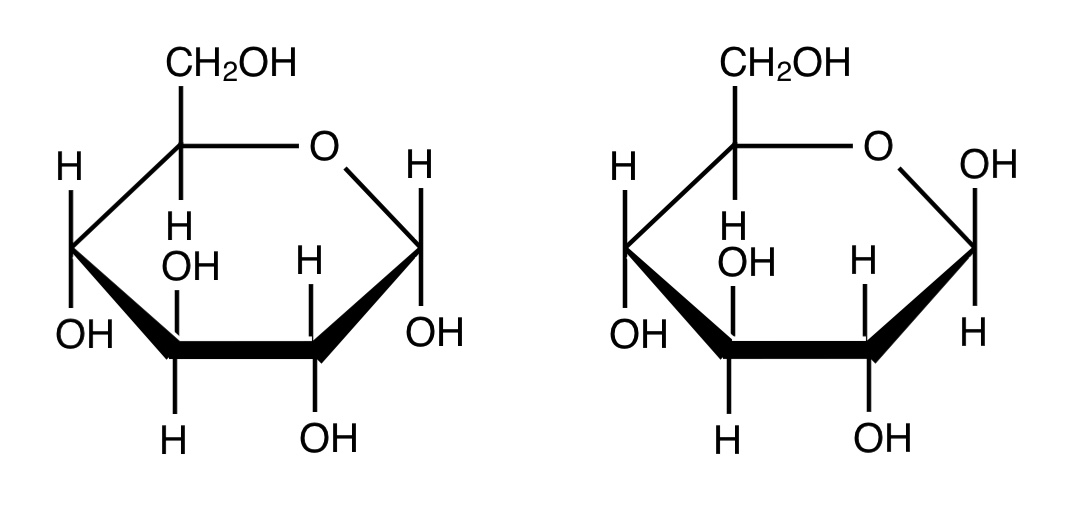
左:α-グルコース 右:β-グルコース
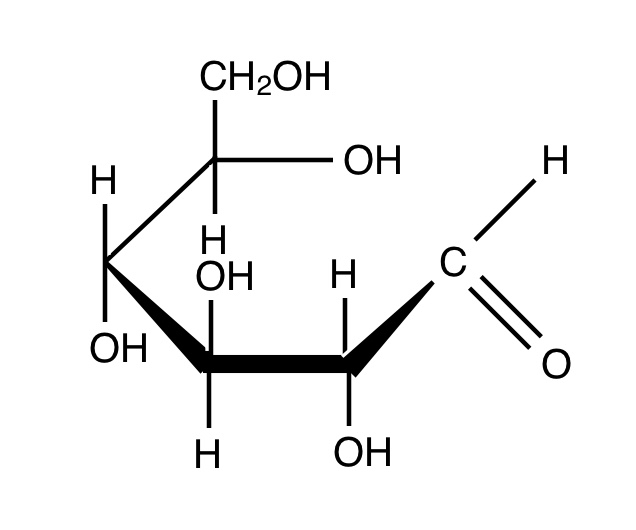
グルコースの六員環のOから右端の-OCH(OH)となっている部分を「ヘミアセタール構造」というのですが、実はここが水溶液中で開環します。
ヘミアセタール構造は開環するとアルデヒド基になります。このアルデヒド基は隣の炭素と単結合で結ばれているので回転できます。
開環して、アルデヒド基が回転して、閉環して、を繰り返すことでグルコース水溶液中ではα-グルコースと開環した鎖状グルコースとβ-グルコースが平衡的に存在することになります。
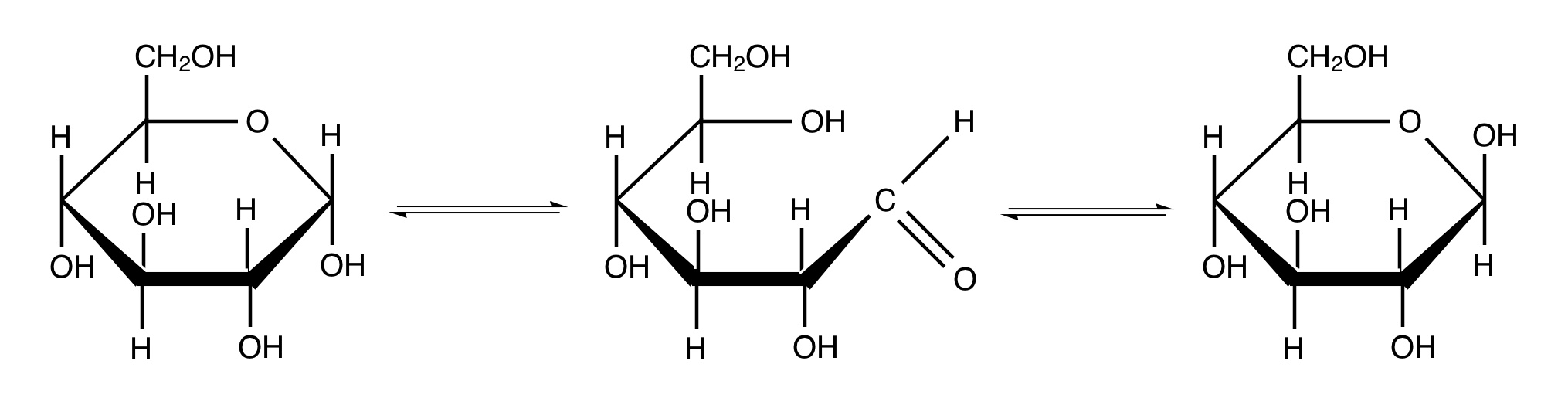
さて、グルコースには2種類(水溶液中では3種類)存在することがわかった上で話を戻しましょう。
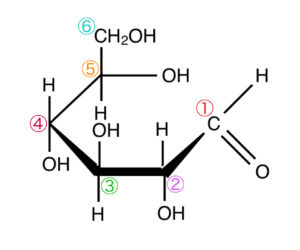
デンプンやセルロースはグルコースが無数に連結したものです。このとき、グルコースの炭素に番号をつけます。番号はヘミアセタール構造中の炭素を1番として順に2番、3番、…と付けていきます。
2つのα-グルコースが1番炭素と4番炭素にあるOH基で脱水縮合したときに出来るのがマルトースという二糖で、このマルトースがさらに結合し続けて高分子になるとデンプンになります。
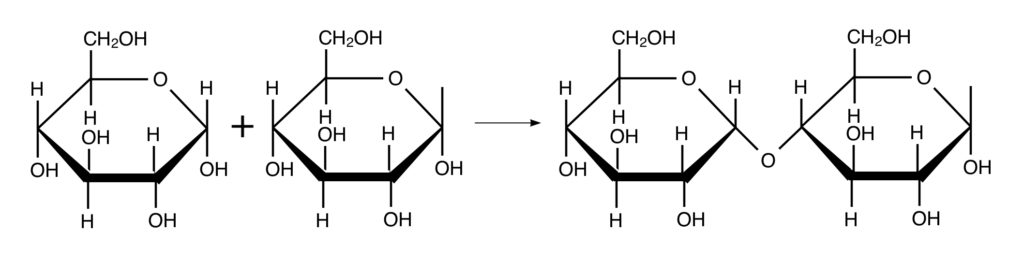
1番と4番のOH基で脱水縮合するのでこれを1,4-結合、このような単糖同士の脱水縮合によって形成される結合を「グリコシド結合」といいます。α-グルコースが1,4結合すると少しずつ曲がっていきます。曲がり続けるとやがて曲線となり分子全体では螺旋構造になるのです。螺旋構造内にヨウ素が入り込むと「ヨウ素デンプン反応」といって青紫色に呈色しますね。
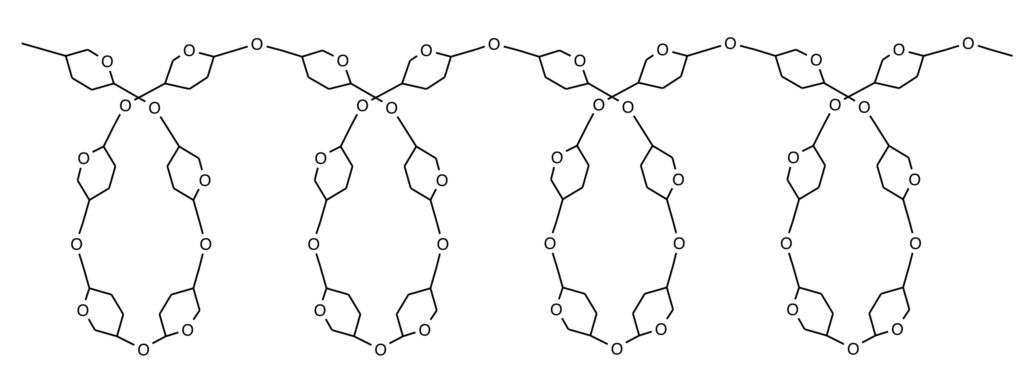
(1,4-結合のみからなる直鎖螺旋構造のデンプンをアミロース、1,4-結合以外に1,6-結合も混じった枝分かれ螺旋構造のデンプンをアミロペクチンといいます)
続いて2つのβ-グルコースが1,4-結合するとセロビオースという二糖になります。
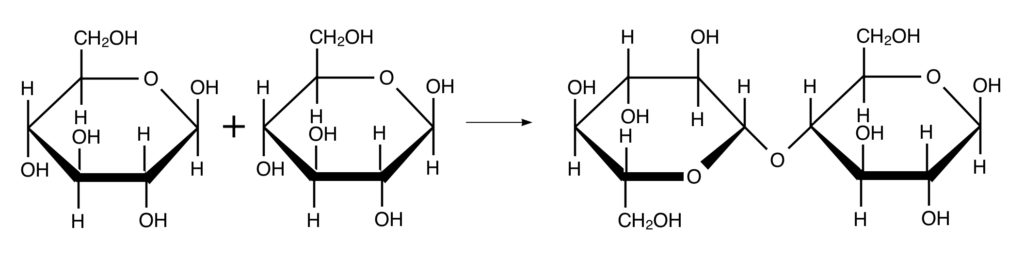
セロビオースがさらに1,4-結合し続けていくとセルロースになります。β-グルコースの1,4-結合はデンプン同様少し曲がります。しかし、次の1,4-結合でさっき曲がった方向とは逆方向に曲がります。これを繰り返していくと分子全体で見れば直線型になります。
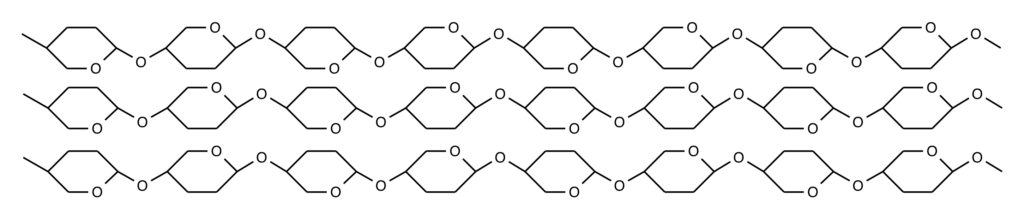
デンプンは螺旋構造、セルロースは直線構造、同じグルコースが無数に結合した多糖でもグルコースがα型、β型なのかによってこんなにも構造が変化してくるんですね。
●セルロースの性質
セルロースは直線型であることがわかりました。直線型、ということはセルロース分子を綺麗に並べることができます。するとセルロースにはグリコシド結合に使われなかった残りのOH基が飛び出していますから分子間で強い水素結合を形成します。
これは例えるとマジックテープのような状態です。この水素結合がかなり厄介で、デンプンは熱水に溶けるのにもかかわらず、セルロースは熱水にはおろか多くの有機溶媒にも溶けません。これを如何にして加工するかがポイントになってくるわけです。
そこでセルロースの強固な水素結合を化学の力でぶった切ります。
●シュバイツァー試薬について
水素結合をぶった切るには強塩基を作用させます。このとき使う強塩基がシュバイツァー試薬と呼ばれるもので、調整自体は簡単です。硫酸銅(II)水溶液に水酸化ナトリウムを入れて水酸化銅(II)の沈殿を得たあと濃アンモニア水を加えてテトラアンミン銅(II)錯イオンを作ります。
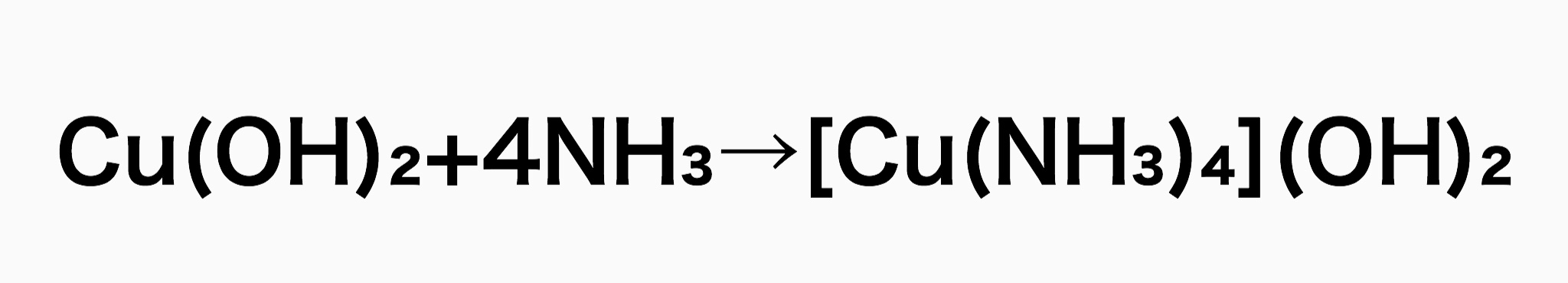
強塩基なら水酸化ナトリウムでもいいじゃん、と思われるかもしれませんが、強塩基性で金属イオンを持つというのが大きなポイントです。
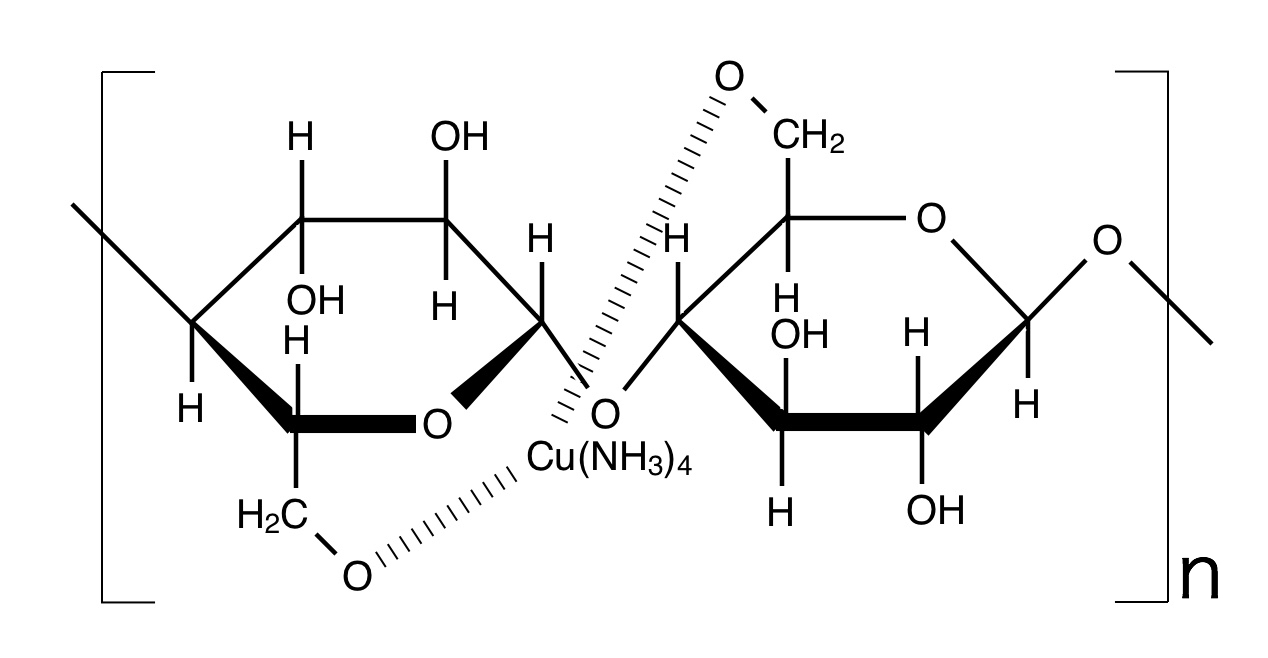
強塩基ということは水酸化物イオンが存在するわけですが、こいつがセルロースのOH基からH⁺を引き抜きます。するとOH基はO⁻になりますね。このO⁻になったところに金属錯イオンが来ますから、もちろん配位結合を形成します。
金属と錯体を形成したセルロースは非常に安定になります。ゆえに水素結合が弱まったままにドロドロ溶けてくれるわけですね。

●再生繊維について
セルロースをシュバイツァー試薬に溶かすと粘性のある液体ができます。これを細く希酸中に絞り出すと繊維ができます。希酸によって塩基が中和されてセルロースが復活します。これを再生繊維といい、特にシュバイツァー試薬を使ったものを銅アンモニアレーヨン(キュプラ)と言います。再生繊維は他にも二硫化炭素に溶かす場合もあり、こちらはビスコースレーヨンと呼ばれます。
レーヨンはサラサラとした肌触りの良い光沢のある布なんかを作れるので衣服(スカート等の裏地)に使われます。
●半合成繊維について
レーヨンはセルロースの水素結合を化学的に断ち切ったのちOH基を再生することで加工したものですが、水素結合を形成するOH基をそもそも他の官能基に変化させて加工性を上げる方法もあります。
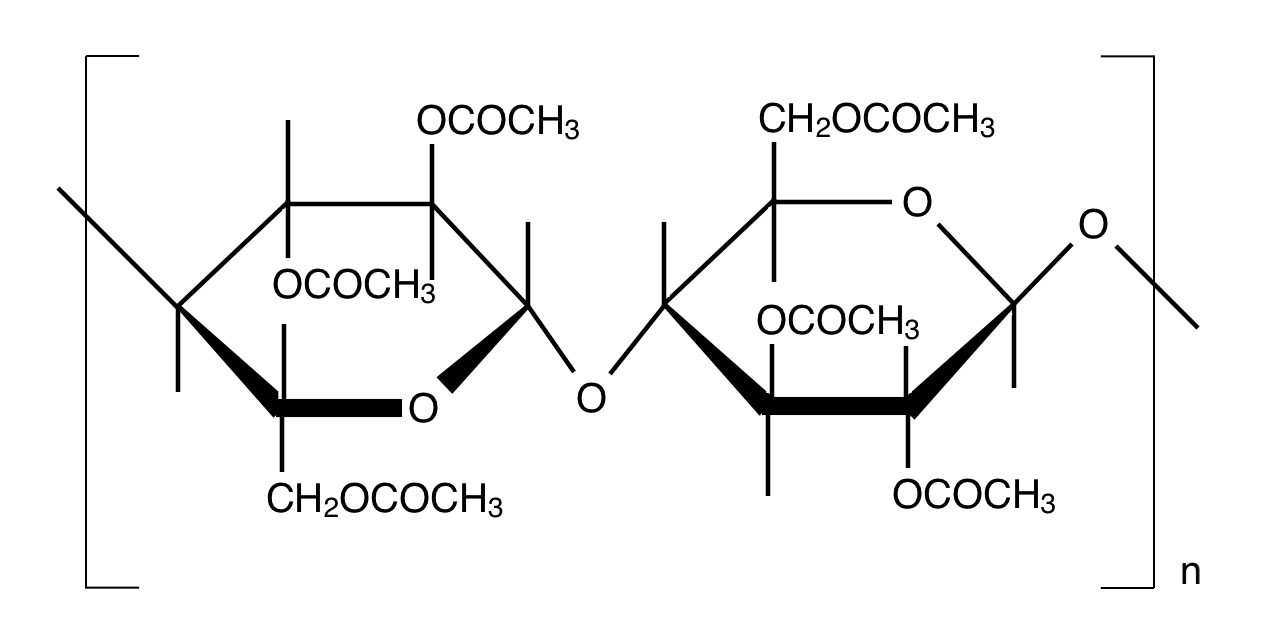
・アセチルセルロース
酢酸無水物でOH基をアセチル化します。
アセチルセルロースを有機溶媒に溶かして繊維に加工すると「アセテート繊維」と呼ばれます。
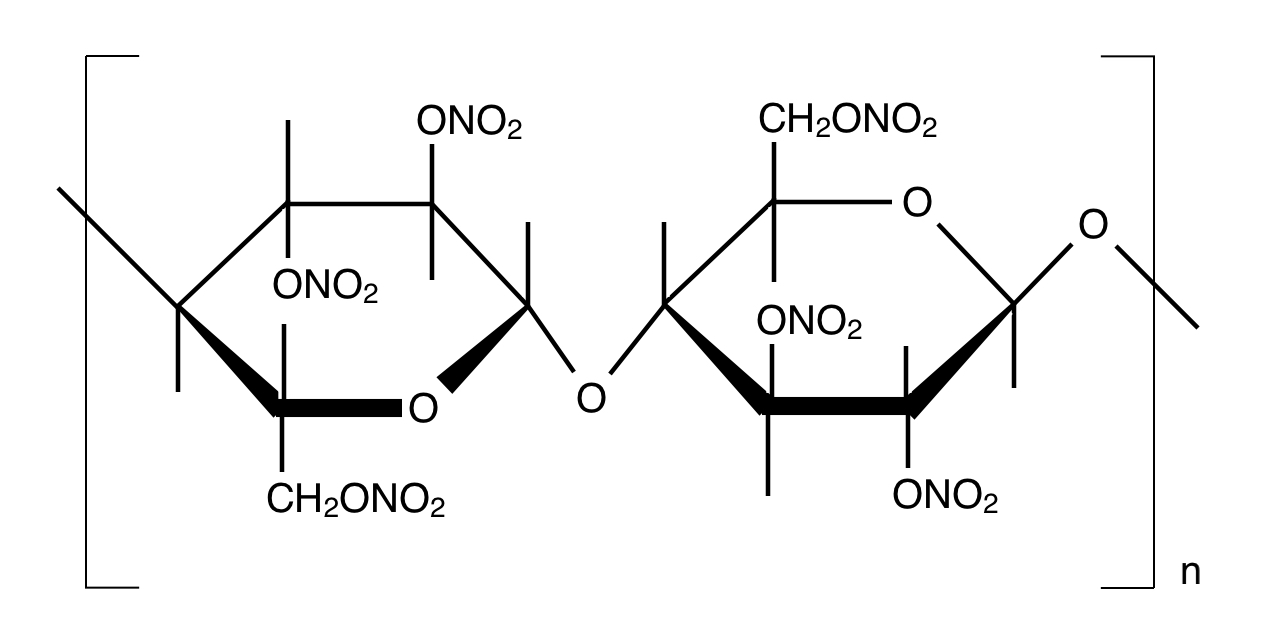
・ニトロセルロース
混酸(濃硝酸と濃硫酸の混合物)でOH基を硝酸エステル化します。有機溶媒に溶かしてコロジオン(水絆創膏)としたり樟脳と混ぜてプラスチックのセルロイドとしたりします。
手品用の一瞬で燃える綿や紙などもニトロセルロースです。

今回の座学はかなりハードで重たい内容になってしまいました。
次回は実際にシュバイツァー試薬を調整して銅アンモニアレーヨン(キュプラ)を合成していきたいと思います。
それでは実験編まで、さよなラジカル。
えざお
〈実験編はこちら〉
【画像引用】
ダイヤクリーニング
≪≪ 戻る
